
| A. | 加热可加快反应速率 | B. | 增大稀硫酸的浓度可加快反应速率 | ||
| C. | 粉碎锌粒可加快反应速率 | D. | 提高锌的纯度可加快反应速率 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| B. | 古有“青蒿一握,以水二升渍,绞取汁”,今用乙醚从黄花蒿中提取青蒿素是利用氧化还原反应原理 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物合物,也属于离子化合物,其阴阳离子冷数比为2:l,过氧化苯甲酞属于有机物 | |
| D. | 二氧化硫有毒,产禁将其添加到任何食品和饮料中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
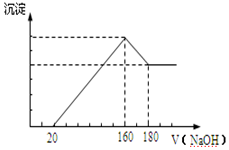 已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题:
已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题: ,A与C形成的10电子分子的电子式为
,A与C形成的10电子分子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水的氧化性强于久置氯水 | |
| B. | 过量铁与Cl2反应时生成FeCl2 | |
| C. | 1molCl2与热NaOH溶液反应生成NaClO3和NaCl时,需NaOH 2mol | |
| D. | 将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单的离子半径:W>Z>Y>X | |
| B. | 五种元素中只有X存在同素异形体 | |
| C. | W和M形成的化合物是离子化合物 | |
| D. | 工业上采用电解W和Z形成的化合物制备W单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VA族 | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | 原子半径大小顺序为X>T>Y | |
| D. | Z元素的最高价氧化物对应的水化的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com