
| 选项 | 实验内容 | 实验目的 |
| A | 将2.5g CuSO4?5H2O溶解在97.5g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 取少量待检固体溶于水中,滴加少量Ba(OH)2溶液,观察是否有白色沉淀生成 | 检验NaHCO3固体中是否含Na2CO3 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |
| A、A | B、B | C、C | D、D |
| 160 |
| 250 |
| 160 |
| 250 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
| A、3:2:2 |
| B、1:3:3 |
| C、2:3:6 |
| D、3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
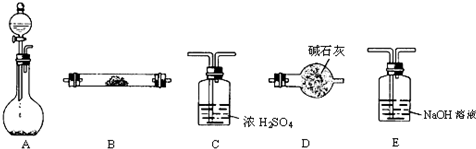
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )
,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )| A、使用了过量的氧化剂 |
| B、没有用乙酸,而是使用了其它催化剂 |
| C、把反应混合物加热 |
| D、所生成的甲萘醌是沉淀物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
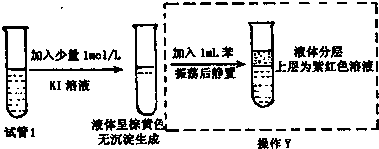
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
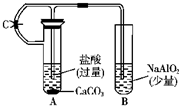 利用如图所示装置进行相关试验,验证铝的化合物的相关性质.请回答:
利用如图所示装置进行相关试验,验证铝的化合物的相关性质.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 溶解 过滤 结晶 |
| B、溶解 过滤 蒸发 结晶 |
| C、加热 溶解 蒸发 过滤 |
| D、溶解 过滤 蒸馏 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
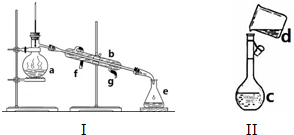
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com