
柠檬烯是一种食用香料,其结构简式如图,有关柠檬烯的分析错误的是
A.在一定条件下,1mol柠檬烯可与2molH2完全加成
B.柠檬烯的一氯代物有7种
C.在一定条件下,柠檬烯可发生加成、取代、氧化、还原反应
D.柠檬烯分子中所有碳原子不可能都在同一平面
科目:高中化学 来源: 题型:
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 | H2(g) | O2(g) | H2O(g) |
| 能量 | 436 | 496 | 926 |
(1)反应2H2(g)+O2(g)===2H2O(g)是________(填“吸热”或“放热”)反应,这说明2 mol H2(g)和1 mol O2(g)具有的能量比2 mol H2O(g)具有的能量________(填“高”或“低”)。
(2)请用图示表示出2 mol H2(g)与1 mol O2(g)生成2 mol H2O(g)的反应过程:

(3)根据表中数据,写出H2(g)与O2(g)完全反应生成H2O(g)的热化学方程式:________________________________________________________________________。
(4)若已知:H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,写出H2(g)与O2(g)完全反应生成H2O(l)的热化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组数据中,前者刚好是后者两倍的是 ( )
A.2 mol水的摩尔质量和1 mol水的摩尔质量
B.200 mL 1 mol/L氯化钙溶液中c(Cl-)和100 mL 2 mol/L氯化钾溶液中c(Cl-)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,某些反应与平衡常数数值如下:2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081 2CO2(g)
2H2O(g) K2=2×1081 2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是
A.常温下,水分解产生O2,此时平衡常数的值约为5×10-80
B.常温下,最易分解放出O2的是水
C.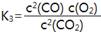 D.以上都不正确
D.以上都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物键线式结构的特点是以线示键,每个折点和线端处表示有一个碳原子,并以氢补足四键,C、H不表示出来,其它原子或原子团要表示出来,例如:CH3CHOHCH3的键线式结构为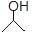 。 CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为
。 CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为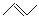 。
。
⑴CH3CH=CHCH3的名称为 ,其所含官能团的结构式为 ,与H2在一定条件下发生加成反应,其产物的同分异构体的键线式结构为 。
⑵完成下列反应方程式,产物用键线式表示: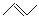 +Br2→ ,反应类型为 反应。
+Br2→ ,反应类型为 反应。
⑶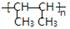 是一种加聚产物,则其单体的结构简式为 ,其链节为
是一种加聚产物,则其单体的结构简式为 ,其链节为
。
⑷写出与CH3CH=CHCH3含有相同官能团的同分异构体的结构简式
。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列离子方程式:
(1)钠与水反应:_______________________________________________________________。
(2)氯气通入水中:_____________________________________________________________。
(3)向氢氧化钠溶液中通入少量CO2:
________________________________________________________________________。
(4)碳酸钙中滴入醋酸溶液:
________________________________________________________________________。
(5)铝片投入氢氧化钠溶液:
________________________________________________________________________。
(6)氯化铝溶液中加足量碳酸氢钠溶液:
________________________________________________________________________。
(7)FeCl3溶液与Cu反应:
________________________________________________________________________。
(8)酸性硫酸亚铁溶液中加入过氧化氢溶液:
________________________________________________________________________。
(9)实验室用MnO2与浓盐酸制取Cl2:
________________________________________________________________________。
(10)NO2溶于水:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是(双选)( )
A.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH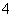
B.将Fe(OH)2溶于过量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
C.用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O===SO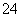 +Cl-+2H+
+Cl-+2H+
D.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表征已达到电离平衡状态的是( )
A.醋酸的浓度达到1 mol·L-1
B.[H+]的浓度达到0.5 mol·L-1
C.[CH3COOH]、[CH3COO-]、[H+]均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新结合成分子的速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com