
 2CuO��CuO+H2SO4=CuSO4+H2O���Աȼķ���������Ϊ��ͬѧ��Ƶ�ʵ�鷽�����ŵ���_______________��
2CuO��CuO+H2SO4=CuSO4+H2O���Աȼķ���������Ϊ��ͬѧ��Ƶ�ʵ�鷽�����ŵ���_______________�� 
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��ˮAlCl3 |
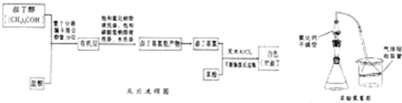
| ʵ�鷽�� | ʵ������ | �ܷ�˵��ˮ�� |
| �ٽ���ƿ�а���ͨ��HNO3�ữ��AgNO3��Һ | ||
| �ڽ����ð�������Һ����ˣ��ò����Թ��壬�� ����ֳ����� |
���ݹ�����ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ե��ʳ��ˮΪ������ȡ�����Ȳ�Ʒ�Ĺ�ҵ��Ϊ���ȼҵ��������Ŀǰ��ѧ��ҵ����Ҫ֧��֮һ��
��1����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ ��
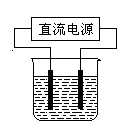
��2�������£�ij��ѧ��ȤС����ʵ�����У���ʯī�缫����ͼװ�ý��е��ijŨ���Ȼ�����Һ��ʵ�飬���һ��ʱ����ռ�����״��������2.24 L��������ǰ����Һ�������Ϊ1 L��������ˮ�����Ļ�������ܽ⣩
�������ϣ�������Һ��c(OH��)= mol/L��
����ʵ�ʲ�÷�Ӧ����Һ��c(OH��)=0.1mol/L���������������ԭ������ǣ�
a��2H2O2H2����O2�����������Ǹ�ԭ�������������Һ��С�������� g��
b��������Ϊ �������ӷ���ʽ��ʾ����
���ⶨ����ʵ������Һʵ�ʼ��ٵ�����Ϊ4.23 g���������������弰�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ����������ͷ����2010�����һģ�������ۺϣ���ѧ���� ���ͣ�ʵ����
(14��)��֪��ͭ�к���������п������������Ƚ����������������ʣ����������Ӧ����ij��ѧ��ȤС����ʵ����������������ͭ��ҺΪ���Һ���õ��ķ���ʵ���˴�ͭ���ᴿ������������͵��Һ�н������л��պͺ����ⶨ��
����һ����⾫�ƣ�
���ʱ����ͭӦ���Դ�� �� _�������������ϵĵ缫��ӦʽΪ �� ��
�������У�����ͭ��Ũ�Ȼ� �� ��ѡ�����䡢��С����
������������ɺ�С��ͬѧ���������̶Ե��Һ���д�����

��1����������ۺ����ã�
ϡ���ᴦ��������õ�������ϡ��Һ������д���ò���Ӧ�����ӷ���ʽ�� �� ���������м������Ļƽ�Ϊ�˻��ս����Dz������й����ϣ����±�����
|
��� |
��Ӧ |
��ѧƽ�ⳣ�� |
|
1 |
Au + 6HNO3��Ũ�� |
<< 1 |
|
2 |
Au3+ + 4Cl- = AuCl4- |
>>1 |
�������п�֪������������ᷴӦ����ȴ��������ˮ��Ũ���������ᰴ�����1��3�Ļ���������ӻ�ѧƽ���ƶ��ĽǶȼ�Ҫ���ͽ��ܹ�������ˮ��ԭ�� �� ��
��2����Һ�����IJⶨ�������Ǹ�С��̽����Һ��һ��ʵ�����̣�

��100mL��Һ��Cu2+ ��Ũ��Ϊ �� mol��L-1 ��Fe2+��Ũ��Ϊ �� mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ�߶���ѧ����ĩ���Ի�ѧ���⣨ѡ�ޣ� ���ͣ������
�Ե��ʳ��ˮΪ������ȡ�����Ȳ�Ʒ�Ĺ�ҵ��Ϊ���ȼҵ��������Ŀǰ��ѧ��ҵ����Ҫ֧��֮һ��
��1����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ ��
��2�������£�ij��ѧ��ȤС����ʵ�����У���ʯī�缫����ͼװ�ý��е��ijŨ���Ȼ�����Һ��ʵ�飬���һ��ʱ����ռ�����״��������2.24 L��������ǰ����Һ�������Ϊ1 L��������ˮ�����Ļ�������ܽ⣩
�������ϣ�������Һ��c(OH��)= mol/L��
����ʵ�ʲ�÷�Ӧ����Һ��c(OH��)=0.1mol/L���������������ԭ������ǣ�
a��2H2O 2H2����O2�����������Ǹ�ԭ�������������Һ��С�������� g��
2H2����O2�����������Ǹ�ԭ�������������Һ��С�������� g��
b��������Ϊ �������ӷ���ʽ��ʾ����
���ⶨ����ʵ������Һʵ�ʼ��ٵ�����Ϊ4.23 g���������������弰�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com