
��100mLNa2CO3��NaAlO2�Ļ����Һ����μ���1mol��L-1�� ���ᣬ�����Һ�е�CO32-��HCO3-��AlO2����Al3+���ӵ����ʵ��������������Һ������仯��ϵ������ͼ��ʾ������˵����ȷ����
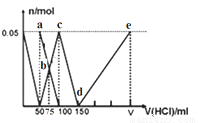
A��a����Һ�У�c(HCO3-)+c(H2CO3)+c(H+)= c(OH-)
B��b��������Һ��������Ũ�ȴ�С˳��Ϊ��c(Cl-)��c(HCO3-)�� c(CO32-)�� c(OH-)
C��c����Һ�У�c(Cl-)+ c(HCO3-) +c(H2CO3) +c(CO32-)=1.5 mol��L-1
D��d��e�Ĺ�����ˮ�ĵ���̶���С
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�����и�һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
���з�Ӧ��˵����Ũ�������Щ�����У�
AŨ�����������ʱ___________________
 B CuSO4��5H2O
B CuSO4��5H2O 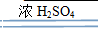 CuSO4 + 5H2O_______________
CuSO4 + 5H2O_______________
C Cu+H2SO4(Ũ) 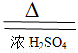 CuSO4 +2H2O+SO2��______
CuSO4 +2H2O+SO2��______
D C6H12O6  6C + 6H2O_____________________
6C + 6H2O_____________________
E C+H2SO4(Ũ) 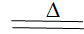 CO2+2H2O+SO2��_________
CO2+2H2O+SO2��_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�����и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ϵͳ�������������Ʋ���ȷ���ǣ� ��
A��1һ������ B��2һ������ C��2��2һ�������� D��3һ�һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Ϊij�л���Ľṹ��ʽ������ȷ������Ϊ�� ��
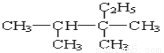
A��2,3��������3���һ����� B��2,3��������2���һ�����
C��2,3,3���������� D��3,3,4����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����������ȷ����
A����Fe(N03)2��Ʒ����ϡH2SO4�μ�KSCN��Һ����Һ��죬��Fe(N03)2��������������
B�������£�pH��Ϊ11������������Һ�Ͱ�ˮ����ˮϡ��100����pH����Ϊ9
C��25��ʱ��Ksp(BaCO3��>Ksp(BaCrO4)�������ˮ���е�Ba2+ѡ��Na2CrO4��Na2CO3��
D����CH3CH2Br��NaOH��Һ���ȣ���ȴ��ȡ���ϲ���Һ������AgNO3��Һ��������������CH3CH2Br��NaOH��Һ�з�����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��OH��������ͬ�������͵������������� �� ��
A��F�� B��NH3 C��H2O D��Na��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ����������и߶���ѧ�����жο���ѧ�Ծ��������棩 ���ͣ������
̼���仯����㷺��������Ȼ���С��ش���������:
��1������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ����� ������
�����ڻ�̬14Cԭ����,������� �������෴�ĵ��ӡ�
��2��̼���γɻ�����ʱ,������Թ��ۼ�Ϊ��,ԭ���� ��
��3��CS2������,���ۼ��������� ,Cԭ�ӵ��ӻ���������� ��
��4��CO�������Fe�γ�Fe(CO)5,�û�������۵�Ϊ-200C�е�Ϊ1030C,��������� ���塣
��5��̼�ж���ͬ��������,����ʯīϩ����ʯ�ľ���ṹ��ͼ��ʾ:

��ʯīϩ������,ÿ��Cԭ������ ����Ԫ��,ÿ����Ԫ��ռ�� ��Cԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ����������и߶���ѧ�����жο���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ�У���H����ȷ��ʾ���ʵ�ȼ���ȵ��ǣ� ��
A��CO(g) +1/2O2(g) ==CO2(g) ��H����283.0 kJ/mol
B ��C(s) +1/2O2(g) ==CO(g) ��H����110.5 kJ/mol
C��H2(g) +1/2O2(g)==H2O(g) ��H����241.8 kJ/mol
D��2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l) ��H����11036 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ�����и߶���ѧ�������Ŀƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʳ��ڷ��ò���Կ��������Ⱦ����( )
A��ʳ�� B���� C��Ũ���� D��Ũ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com