
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,用化学用语回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)空气中含量最多的气体是____________;
(2)化学性质最不活泼的单质是 _________;
(3)Mg的原子结构示意图为_____________;
(4)C与O中,原子半径较小的是________ ;
(5)常用于制造光导纤维的是___________
(6)组成物质种类最多的元素是_________;
(7)H2S和H2O中,热稳定性较弱的是_________;
(8)元素最高价氧化物对应的水化物中,酸性最强的是_________
(9)钠的两种氧化物,分别是_________ 和 __________;
(10)写出铝的氧化物与氢氧化钠溶液反应的化学方程式___________________。
【答案】 N2 Ne 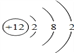 O SiO2 C H2S HClO4 Na2O Na2O2 Al2O3 + 2NaOH = 2 NaAlO2 +H2O
O SiO2 C H2S HClO4 Na2O Na2O2 Al2O3 + 2NaOH = 2 NaAlO2 +H2O
【解析】试题分析:(1)根据空气的成分回答;(2)最外层电子数为8的原子化学性质稳定;(3)根据核外电子排布规律书写Mg的原子结构示意图;(4)同周期元素从左到右半径减小;(5)光导纤维的成分是SiO2;(6)碳原子最外层有4个电子,能与其他原子形成4个共价键;(7)非金属性越强,气态氢化物越稳定;(8)非金属性越强,最高价氧化物对应的水化物酸性越强;(9)钠可以形成氧化钠、过氧化钠两种氧化物;(10)氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
解析:(1)空气中主要含有氮气、氧气,氮气占![]() ,空气中含量最多的气体是N2;(2)Ne最外层电子数为8,所以性质最稳定的是Ne;(3)Mg原子核外有12个电子,原子结构示意图是
,空气中含量最多的气体是N2;(2)Ne最外层电子数为8,所以性质最稳定的是Ne;(3)Mg原子核外有12个电子,原子结构示意图是 ;(4)C和O同周期,从左到右半径减小,所以半径较小的是O;(5)光导纤维的成分是SiO2,制造光导纤维的是SiO2;(6)碳原子最外层有4个电子,能与其他原子形成4个共价键,所以组成物质种类最多的元素是C;(7)非金属性越强,气态氢化物越稳定,O的非金属性大于S,所以H2S和H2O中,热稳定性较弱的是H2S;(8)非金属性越强,最高价氧化物对应的水化物酸性越强,酸性最强的是HClO4;(9)钠钠的两种氧化物,分别是Na2O和 Na2O2;(10)氧化铝与氢氧化钠溶液反应生成偏铝酸钠,反应方程式是Al2O3 + 2NaOH = 2 NaAlO2 +H2O;
;(4)C和O同周期,从左到右半径减小,所以半径较小的是O;(5)光导纤维的成分是SiO2,制造光导纤维的是SiO2;(6)碳原子最外层有4个电子,能与其他原子形成4个共价键,所以组成物质种类最多的元素是C;(7)非金属性越强,气态氢化物越稳定,O的非金属性大于S,所以H2S和H2O中,热稳定性较弱的是H2S;(8)非金属性越强,最高价氧化物对应的水化物酸性越强,酸性最强的是HClO4;(9)钠钠的两种氧化物,分别是Na2O和 Na2O2;(10)氧化铝与氢氧化钠溶液反应生成偏铝酸钠,反应方程式是Al2O3 + 2NaOH = 2 NaAlO2 +H2O;


科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. Na2S水解:S2﹣+2 H2OH2S+2OH﹣
B. 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+
C. 向次氯酸钙溶液通入过量CO2:Ca2++2ClO﹣+H2O+CO2═CaCO3↓+2HClO
D. 向次氯酸钙溶液通入SO2:Ca2++2ClO﹣+H2O+SO2═CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 不能用玻璃瓶来盛装氟化钠水溶液
B. 适量CO2通入漂白粉的水溶液可以生成白色沉淀
C. 在燃煤中加入石灰石可减少SO2的排放,发生的总反应为 2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D. 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列说法正确的是
A.我国研制的重组新冠疫苗,需要冷藏保存
B.医用酒精灭杀新冠病毒是利用其氧化性
C.新冠病毒由 C、H、O三种元素组成
D.为增强“84”消毒液的消毒效果,可加入过量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为_____________,制得的气体可用如图所示装置收集,则气体应从______(填“A”或“B”)通入。
![]()
(2)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(3)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是__________________________。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为__________________________________。
(5)取一定量的X晶体分解,若生成1 mol F,则必同时生成_______________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.人造奶油、大豆油、汽油的主要成分都是油脂
B.植物秸秆和土豆淀粉的水解产物在一定条件下可以发酵转化成酒精
C.蛋白质溶液中加入稀的(NH4)2SO4溶液,有固体析出,加水可重新溶解
D.生活中常见的合成橡胶、有机玻璃、酚醛树脂都是通过加聚反应制备的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.SiO2硬度大与Si、O原子间的成键方式和排列方式有关
B.Al2O3熔点高,说明其中的共价键较难被削弱
C.NaOH晶体熔化时克服了离子键和共价键
D.H2O2受热易分解是因为分子间作用力弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业品纯碱中常含有少量的NaCl等杂质,图中的仪器装置可用来测定纯碱中Na2CO3的质量分数,图中标号:①空气;②某溶液,③纯碱样品,④稀H2SO4,⑤浓H2SO4,⑥碱石灰,⑦碱石灰。
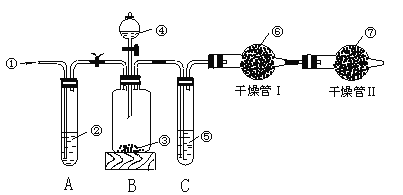
实验步骤是:
①检查装置的气密性; ②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1 g)。
③准确称量一定量的纯碱的质量(设为m2 g),并将其放入广口瓶中;
④从分液漏斗中缓缓滴入稀H2SO4,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为m3 g)。
根据上述实验,回答下列问题:
(1)鼓入空气的目的是______________________________。
(2)装置A中液体②应为______,其作用是______________________,如撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将____________(填“偏大”“偏小”或“不变”)。
(3)装置C的作用是_____________,如果撤去装置C,则会导致实验结果_______(填“偏大”“偏小”或“不变”)。
(4)干燥管Ⅱ的作用是____________________。
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是:______________________,如果这两步操作太快,则会导致实验测定结果____________(填“偏大”“偏小”或“不变”)。
(6)根据实验,纯碱中Na2CO3的质量分数的计算式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体.实验室制取溴乙烷的反应如下:NaBr + H2SO4(浓) ![]() NaHSO4+HBr;CH3CH2OH+HBr→CH3CH2Br + H2O
NaHSO4+HBr;CH3CH2OH+HBr→CH3CH2Br + H2O
已知反应物的用量:①NaBr(s) 0.3 mol.②浓硫酸36 mL (98%.密度.84 g·cm3). ③乙醇0.25 mol.④水25 mL.其中乙醇的密度为水的密度的4/5.
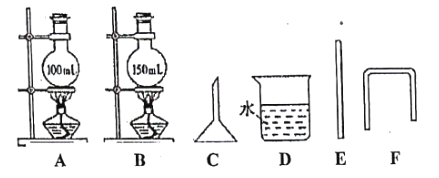
试回答:
(1)选择上图中必要的实验仪器安装制取和收集溴乙烷的装置,要求达到安全、担失少、不污染环境的目的.有关仪器(相关胶塞上己打合适的孔,胶管未画出)的连接顺序为__(填字母).
(2)若试剂加入过快.可看到烧瓶内有红棕色气体产生.写出反应的化学方程式:________。
(3)判定有溴乙烷生成的现象是____________________________。
(4)从棕黄色的粗溴乙烷制取无色的溴乙烷,可以加入______(A. NaOH溶液 B.CCl4 C. NaHSO3溶液),本操作中通常使用的仪器是__________.
(5)本实验的产率为60%,则可制取溴乙烷____________g(保留三位有效数字).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com