
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为___________________;10min生成SO3的化学反应速率为___________________。
(2)下列关于该反应的说法正确的是___________________。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式:____________。
【答案】4mol/L 0.3mol/(L·min) A、C SO2+2NH3·H2O=2NH4++SO32-+H2O
【解析】
(1)起始时充入SO2和O2,反应一段时间后生成SO3,浓度为3mol/L,说明反应消耗的SO2的浓度为3mol/L,故起始时SO2的浓度为1mol/L +3mol/L =4mol/L;10min内SO3的生成速率v=![]() =
=![]() =0.3mol/(L·min);
=0.3mol/(L·min);
(2)A.增加氧气浓度,使反应物浓度增加,单位体积内活化分子百分数增加,反应速率加快,A正确;
B.降低温度,单位体积内活化分子百分数降低,反应速率减慢,B错误;
C.加入催化剂可以降低化学反应活化能,使体系中活化分子百分数增加,加快反应速率,C正确;
D.该反应为可逆反应,反应不可能完全转化,故达到反应限度时SO2不能全部转化为SO3,D错误;
故选AC;
(3)氨水显碱性,SO2为酸性气体,二者可以发生反应生成硫酸铵,反应的离子方程式为SO2+2NH3·H2O=2NH4++SO32-+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
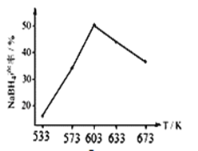
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
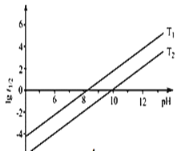
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L己烷中含有碳原子的数目为6NA
B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置__________;
(2)写出一种由a、c、d所形成的离子化合物__________ (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是_____________________;
(3)c的单质的电子式为__________。
(4)b和d相比,非金属性较强的是__________ (用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态
B.d的氢化物的稳定性强于b的氢化物
C.b与d形成的化合物中,b呈正价
D.d的氢化物的沸点高于b的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
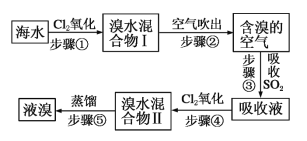
(1)步骤①反应的离子方程式是___________________。
(2)步骤③反应的化学方程式是___________________,从理论上考虑,下列也能吸收Br2的是___________________。
A.FeCl2 B.Na2SO3 C.H2O
(3)步骤①中已获得Br2,步骤③中又将Br2还原为Br-,步骤④又生成Br2,这样做的目的为___________________。
(4)已知海水中Br-含量为64mg/L,依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为___________________L(忽略Cl2的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为: |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的官能团名称为________。写出A在一定条件下反应生成高分子化合物的方程式:___________________。
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=___________________时,这类有机物开始出现同分异构体。
(3)关于B的说法正确的是:___________________。
a、所有原子在同一个平面上 b、六个碳原子之间是单双建交替的结构
c、一个B分子含有6个σ键 d、含有苯环的化合物成为芳香化合物
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为___________________;其化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出至少六种,C与H原子个数比为1:2且相对分子量最小的不同类别的有机物的名称____、_____、____、_____、_____、______。
(2)有一种耐热型树脂材料的结构简式为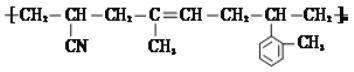
写出其合成单体除丙烯氰(CH2=CHCN)外,还需要的单体名称是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( )
A.CO全部转化为乙醇
B.反应体系中乙醇的物质的量浓度不再变化
C.正反应和逆反应的化学反应速率均为零
D.CO和H2以1:2的物质的量之比反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:

下列叙述错误的是
A. 实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B. 装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C. 向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4Cl
D. 用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com