
分析 (1)依据天平的正确使用方法解答;
(2)依据称量固体药品时,添加药品的正确操作解答;
(3)依据配制一定物质的量浓度溶液的操作步骤及每步用到的仪器解答;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)天平的正确使用步骤:
C.在天平的两边托盘上各放一张干净等质量的滤纸,调节天平两边螺丝使天平平衡;
F.在右盘放置5g砝码.
A.将游码拨至0.2g处;
E.往左盘内逐步添加晶体至天平平衡;
D.取走药品,将砝码放回砝码盒内;
B.将游码拨至“0”处;
所以正确的顺序为:FAEDB,
故答案为:FAEDB:
(2)称量固体药品时,添加药品只缺少量晶体时,应左手拿药匙,用右手轻拍左手手腕,小心振动药匙加足药品,使天平平衡;
故答案为:左手拿药匙,用右手轻拍左手手腕,小心振动药匙加足药品,使天平平衡;
(3)配制一定物质的量浓度溶液的操作步骤:计算、称量、溶解、移液、洗涤、定容、摇匀,溶解时,固体应放在烧杯中,用玻璃棒不断搅拌;
故答案为:烧杯、玻璃棒;250mL容量瓶;定容;
(4)A.将砝码放在左盘上,BaCl2放在右盘上进行称量,导致称取的溶质质量偏小,物质的量偏小,溶液的浓度偏低,故A选;
B.选用的容量瓶内有少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不受影响,故B不选;
C.定容摇匀后,液面下降,又加水至刻度线,导致溶液的体积偏大,溶液的浓度偏低,故C选;
D.整个配制过程中,容量瓶不振荡,会导致溶液混合不均匀,溶液的体积可能偏大或偏小,溶液的浓度可能偏低或偏高,故D不选;
故选:AC.
点评 本题考查了配制一定物质的量浓度溶液,题目难度不大,侧重考查学生对实验基本操作的掌握程度,明确实验原理和基本操作是解题关键,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 断裂1 mol H2O中的化学键需要吸收925.6 KJ的能量 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4 KJ•mol-1 | |
| C. | 2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
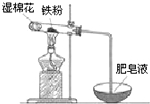 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
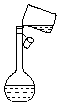 实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)
实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题.(已知所用98%浓硫酸的密度为1.84g/mL)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正丁烷的结构简式:C4H10 | |
| B. | S2-的结构示意图: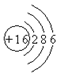 | |
| C. | NH3的电子式: | |
| D. | 碳酸钠电离方程式:Na2CO3=Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属,化合物 | B. | 金属氧化物,碱性氧化物 | ||
| C. | 泥沙,胶体 | D. | 单质,纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com