
| ���� | H2 | CO | CH3OH |
| Ũ�ȣ�mol/L�� | 0.2 | 0.1 | 0.4 |
���� ��1����ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ���ݴ�д���÷�Ӧ��ƽ�ⳣ������ʽ��
��2�����ȸ���v=$\frac{��c}{��t}$������ü״���ʾ�ķ�Ӧ���ʣ�Ȼ�����û�ѧ��Ӧ�����뻯ѧ�����������ȼ������������ʾ�ķ�Ӧ���ʣ�
�ڿ��淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽��н��
�۸��ݸ�˹���ɣ�a-b+4c�ɵ�Ŀ�귴Ӧ2CH3OH��l��+2O2��g���T2CO��g��+4H2O��l���ݴ˼�������H��
��3��ȼ�ϵ���У�����ʧȥ���ӱ������������õ����ӱ���ԭ���״��ڷ�Ӧ��ʧȥ���ӱ���������״�Ϊ�������ڼ��������¼״��ŵ�����̼��أ����������õ������������������ӣ�
��� �⣺��1����ӦC��s��+H2O��g���TCO��g��+H2��g����ƽ�ⳣ������ʽΪ��K=$\frac{c��{H}_{2}��•c��CO��}{c��{H}_{2}O��}$��
�ʴ�Ϊ��K=$\frac{c��{H}_{2}��•c��CO��}{c��{H}_{2}O��}$��
��2����ƽ��ʱ�״���Ũ��Ϊ0.4mol/L�����ʱ����ڼ״���ƽ����Ӧ����Ϊ��v��CH3OH��=$\frac{0.4mol/L}{10min}$=0.04mol/��L•min�������ݻ�ѧ��Ӧ�����뻯ѧ�����������ȿ�֪��v��H2��=2v��CH3OH��=0.08mol/��L•min����
�ʴ�Ϊ��0.08mol/��L•min����
��a����Ӧ2H2��g��+CO��g��?CH3OH��g��Ϊ���������С�ķ�Ӧ����Ӧ������ѹǿ���ϱ仯������ϵѹǿ����ʱ���������淴Ӧ������ȣ��ﵽƽ��״̬����a��ȷ��
b���÷�Ӧǰ�������壬��������������䣬���������ݻ����䣬����������ܶ�ʼ�ղ��䣬�ܶȲ�����Ϊ�ж�ƽ��״̬�����ݣ���b����
c����Ӧ��������������ʵ������ϼ�С���������������ʼ�ղ��䣬���������ƽ��Ħ������Ϊ����������������ƽ��Ħ����������ʱ�������÷�Ӧ�ﵽƽ��״̬����c��ȷ��
d��v����H2��=v����CH3OH������ʾ�������淴Ӧ���ʣ����Dz����㻯ѧ��������ϵ��˵���÷�Ӧû�дﵽƽ��״̬����d����
�ʴ�Ϊ��ac��
��a��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H 1
b��2CO ��g��+O2��g���T2CO2��g����H2
c��H2O��g���TH2O��l����H3
���ݸ�˹���ɣ�a-b+4c�ɵã�2CH3OH��l��+2O2��g��=2CO��g��+4H2O��l����H=��H 1-��H 2+4��H3��
�ʴ�Ϊ����H 1-��H 2+4��H3��
��3���� CH3OH Ϊȼ�ϣ��� KOH ��Һ���������Һ�����Ƴ� CH3OH ȼ�ϵ�أ��״��ڷ�Ӧ�б�������̼��أ������ CH3OH�ĵ缫Ϊ�����������������õ������������������ӣ�������Ӧ�ĵ缫��ӦʽΪ��O2+2H2O+4e-=4OH-��
�ʴ�Ϊ������O2+2H2O+4e-=4OH-��
���� ���⿼���Ϊ�ۺϣ��漰��ѧƽ�ⳣ������ѧ��Ӧ���ʵļ��㡢ԭ��ع���ԭ������˹���ɵ�Ӧ�õ�֪ʶ����Ŀ�Ѷ��еȣ�ע�����ջ�ѧƽ�ⳣ������ѧ��Ӧ���ʵĸ������ʽ����ȷ��˹���ɵ����ݡ�ԭ���ԭ����Ӧ�÷���������������ѧ���ķ������������������Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
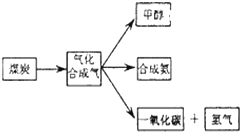
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȡ25 g CuSO4•5H2O����1 Lˮ�� | |
| B�� | ȡ16 g CuSO4•5H2O��������ˮ�У���ϡ����1 L | |
| C�� | ȡ16 g��ˮCuSO4����1 Lˮ�� | |
| D�� | ȡ25 g CuSO4•5H2O����ˮ���1 L��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| H2��g�� | Br2��g�� | HBr ��g�� | |
| 1mol�����еĻ�ѧ������ʱ�����յ�������KJ�� | 436 | a | 369 |
| A�� | 404 | B�� | 260 | C�� | 230 | D�� | 200 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.5mol | B�� | 0.25mol | C�� | 0.1mol | D�� | 0.125mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
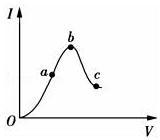 �Ķ�������Ϣ��������и���
�Ķ�������Ϣ��������и����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Ӧ��aA��g��+bB��g��?cC��g����H��0 ��2L���������н��У��ı�������Ӧ�������ڵ�һ���ڶ��͵�������ϵ�и����ʵ����ʵ�����ʱ��仯��������ͼ��ʾ��
��Ӧ��aA��g��+bB��g��?cC��g����H��0 ��2L���������н��У��ı�������Ӧ�������ڵ�һ���ڶ��͵�������ϵ�и����ʵ����ʵ�����ʱ��仯��������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ��˳�� | ʵ������ | ʵ������ |
| �� | A+B | ������ |
| �� | B+D | ������ų� |
| �� | C+B | ������� |
| �� | A+D | ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com