
| A. | 5min内P的平均反应速率为0.15mol/(L•min) | |
| B. | Q的平衡浓度为1mol/L | |
| C. | Q的转化率为25% | |
| D. | x是2 |
分析 A.利用达到平衡生成1molN,求出参加反应的P的量,进而求出其反应速率;
B.利用达到平衡生成1molN,求出参加反应的Q的量,进而求出Q的平衡浓度;
C.计算参加反应的Q的物质的量,根据转化率定义计算;
D.利用速率之比等于化学计量数之比,求出x.
解答 解:A.已知达到平衡生成1molN,则参加反应的P为n(P)=$\frac{3}{2}$×1mol=1.5mol,所以v(P)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15 mol/(L•min),故A正确;
B.已知达到平衡生成1molN,则参加反应的Q为n(Q)=$\frac{1}{2}$n(N)=0.5mol,所以Q的平衡浓度为:$\frac{2.5mol-0.5mol}{2L}$=1 mol/L,故B正确;
C.参加反应的Q为n(Q)=$\frac{1}{2}$n(N)=0.5mol,故Q的转化率为:$\frac{0.5mol}{2.5mol}$×100%=20%,故C错误;
D.根据A选项可知v(P)=0.15 mol/(L•min),而M的平均速率是0.1mol/(L•min),根据速率之比等于化学计量数之比,则:$\frac{x}{3}$=$\frac{0.1mol/(L•min)}{0.15mol/(L•min)}$,解得:x=2,故D正确;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答结构,注意掌握化学反应速率的概念及计算方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
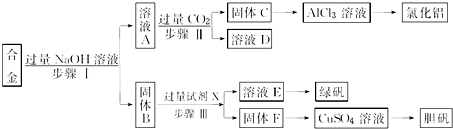
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+HCl↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | Mg+Cl2$\frac{\underline{\;点燃\;}}{\;}$MgCl2 | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增大效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: | B. | S2-的结构示意图: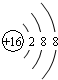 | ||
| C. | CH4的球棍模型示意图为: | D. | 用电子式表示HCl形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3与氢碘酸溶液反应Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 电解MgCl2溶液Mg2++2H2O+2Cl-═Mg(OH)2↓+Cl2↑+H2 | |
| C. | Zn与氯化铵溶液反应生成气体Zn+2NH4+═Zn2++4H2↑+N2↑ | |
| D. | 向明矾的水溶液中滴加足量Ba(OH)2溶液Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向溶液中滴加BaCl2溶液,再加入盐酸 | 产生白色沉淀不溶解 | 原溶液中有SO42- |
| B | 将黄豆粒大的钠放入CuSO4稀溶液中 | 产生红色固体 | 金属性:Na>Cu |
| C | 向1mL20%的蔗糖溶液中加入几滴稀硫酸,水浴加热后取少量NaOH溶液,再加入新制的Cu(OH)2,加热 | 产生砖红色沉淀 | 蔗糖水解产生葡萄糖 |
| D | 向盛有少量Na2O2固体的试管中加入一定量的蒸馏水,再滴加酚酞试液 | 溶液变红后褪色 | 说明可能生成了H2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com