
【题目】某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=﹣lgc(Ag+),pX=﹣lgc(X﹣),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X﹣)的相互关系.下列说法错误的是( ) 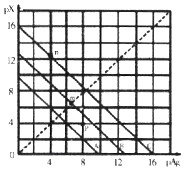
A.A线是AgCl的溶解平衡曲线
B.坐标点p形成的溶液是AgCl的不饱和溶液
C.m点是在水中加入足量的AgBr形成的饱和溶液
D.n点表示由过量的KI与AgNO3反应产生AgI沉淀
【答案】D
【解析】解:A.已知pAg=﹣lgc(Ag+),pX=﹣lgc(X﹣),银离子、氯离子浓度越大,浓度的负对数得到数值越小,依据图象分析可知,氯化银溶解度大于溴化银大于碘化银,溶液中的离子浓度也是氯化银溶解度大于溴化银大于碘化银,所以A线表示俄是AgCl,B线表示的是AgBr,C线表示的是AgI,故A正确; B.坐标点p(8,4),与平衡线相比较,c(Cl﹣)较小,是AgCl的不饱和溶液,故B正确;
C.m点是沉淀溶解平衡线上的一点,说明是沉淀溶解平衡状态下的饱和溶液,故C正确;
D.因为n点在曲线上,即处于沉淀﹣溶解平衡状态,不存在生成沉淀或有部分沉淀溶解的问题,表示的是碘化银沉淀的溶解沉淀平衡状态,故D错误;
故选D.
A.已知pAg=﹣lgc(Ag+),pX=﹣lgc(X﹣),银离子、氯离子浓度越大,浓度的负对数得到数值越小,以此判断;
B.坐标点p(8,4),与平衡线相比较,c(Cl﹣)较小;
C.m点是沉淀溶解平衡线上的一点,说明是沉淀溶解平衡状态下的饱和溶液;
D.n点时存在溶解平衡,为饱和溶液状态.


科目:高中化学 来源: 题型:
【题目】为验证同主族元素性质的递变规律。某小组用如图所示的装置进行实验( 夹持仪器 已略去,装置气密性已检验)。
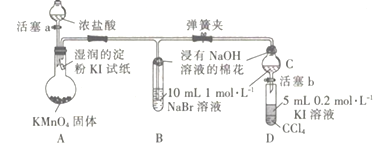
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当装置B和装置C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当装置B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)装置A 中发生的置换反应的化学方程式为___________________。
(2)装置B的溶液中NaBr完全被氧化,则消耗Cl2 的物质的量为_______________。
(3)为验证溴元素的非金属性强于碘元素,过程Ⅳ的操作和现象是_____________________。
(4)氯水和二氧化硫气体均有漂白作用,但两者混合使用却失去漂白作用,其原因是___________________ (用离子方程式表示)。
(5)设计实验方案证明Fe3+的氧化性比I2 强(写出实验操作过程、实验现象与结论):____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温常压下,1mol任何气体的体积都约为22.4L
B. 标准状况下,气体的摩尔体积约为22.4L
C. 标准状况下,32gO2的体积约为22.4L
D. 标准状况下,22.4L氖气含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 胶体的分散质粒子直径在10-9-10-7m之间
B. 胶体较稳定的原因是胶体带电
C. 可用渗析法提纯胶体
D. 可利用丁达尔效应区分溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器内发生可逆反应3A+m Bn C达到平衡.
(1)若A、C均为气体,B为固体,则平衡常数表达式为K=;
(2)若A、B、C均为气体,在减小压强时平衡正向移动,则3+mn(填“>”、“<”或“=”);
(3)若该反应在任何温度下都能自发进行,则△H<0,△S0(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法错误的是( )
选项 | 物质 | 杂质 | 试剂 | 主要操作 |
A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
B | Mg | Al | NaOH | 过滤 |
C | FeCl2 | FeCl3 | Cu | 过滤 |
D | KNO3 | KCl | H2O | 冷却结晶 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一化学平衡:mA(g)+nB(g)pC(g)+qD(g).如图表示的是A的转化率与压强、温度T的关系.分析图中曲线可以得出的结论是( ) 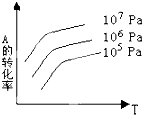
A.正反应吸热,m+n>p+q
B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q
D.正反应放热,m+n<p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
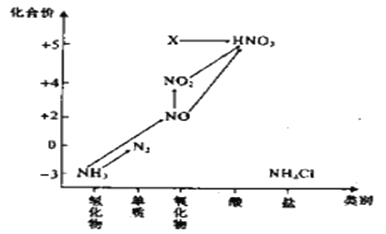
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________________________________________________________________。
(2)氮氧化物对大气污染主要的危害是____________________。(填一点即可)
(3)若要将NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na
C.NH4Cl D.NO2
(4)图中X转化为HNO3的化学方程式为:____________________________________。
(5)图中在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度M,其数值大小范围为___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com