
(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:

①A分子中的官能团名称是____________;
②A只有一种一氯取代物B,写出由A转化为B的化学方程式:________________________________________________________________________;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种,F的结构简式是
______________________________________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)____________________。
①加成反应 ②氧化反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是______________________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到分子式为C10H12O2Na2的化合物。
“TBHQ”的结构简式是____________________。
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:阅读理解
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.



查看答案和解析>>
科目:高中化学 来源: 题型:
 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.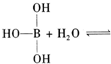
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com