
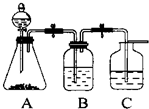
 设计一个简单的一次性完成实验的装置图,验证醋酸溶液,二氧化碳水溶液,苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.
设计一个简单的一次性完成实验的装置图,验证醋酸溶液,二氧化碳水溶液,苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.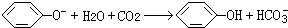 .
. 分析 较强的酸能制取较弱的酸,较弱的酸能制取最弱的酸,以此来分析;
(1)B装置中应盛放能吸收杂质的药品,且不能导致气体中引进新的杂质;
(2)苯酚钠能和二氧化碳、水反应生成苯酚和碳酸氢钠.
解答 解:根据强酸制取弱酸的原则,分液漏斗中应盛放最强的酸,最强的酸是醋酸,所以分液漏斗中所盛试剂名称是醋酸,
(1)醋酸有挥发性,导致二氧化碳气体中含有醋酸,会对实验造成干扰,所以B装置要盛放能除去醋酸,且不引起二氧化碳产生新的杂质、不能和二氧化碳反应的药品,一般常用碳酸氢钠溶液;该试剂的作用是除去二氧化碳中的醋酸杂质,
故答案为:饱和NaHCO3溶液;除去CO2中混有的醋酸杂质;
(2)苯酚钠能和二氧化碳、水反应生成苯酚和碳酸氢钠,C中溶液变浑浊,反应方程式为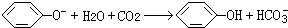 ,
,
故答案为:C中溶液变浑浊;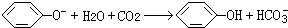 .
.
点评 本题考查了比较弱酸相对强弱的探究实验,难度不大,注意苯酚钠和二氧化碳、水反应生成碳酸氢钠不是碳酸钠.


科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯能使溴水褪色 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 葡萄糖分子结构中只有一个醛基,所以是单糖 | |
| D. | 生成高分子化合物的常见反应是加聚反应和缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| B. | 用水鉴别己烷、四氯化碳、酒精三种无色液体 | |
| C. | 将苯和溴水混合制取溴苯 | |
| D. | 可用酸性高锰酸钾溶液鉴别甲烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
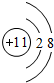 .B存在同素异形现象,其中常用作消毒剂的是O3.(填化学式)
.B存在同素异形现象,其中常用作消毒剂的是O3.(填化学式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①⑤⑦ | C. | ③④⑤⑥ | D. | ②③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
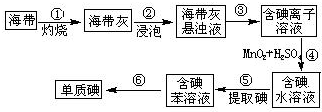 碘在工农业生产和日常生活中有重要用途.
碘在工农业生产和日常生活中有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定有甲烷 | ||
| C. | 可能有乙烷 | D. | 一定是甲烷和乙烯的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com