
 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.分析 (1)若将4mol A和2mol B在2L的容器中混合,经2s后测得C的浓度为0.6mol/L,由方程式可知△c(A)=△c(C),△c(B)=$\frac{1}{2}$△c(C),根据v=$\frac{△c}{△t}$计算v(A),2s时物质B的浓度=B的起始浓度-△c(B);
(2)设参加反应的B为xmol,则:
2A(g)+B(g)?2C(g)
起始量(mol):a b 0
变化量(mol) 2x x 2x
平衡量(mol)a-2x b-x 2x
达到平衡时它们的物质的量满足:n(A)+n(B)=n(C),即a-2x+b-x=2x,解得x=$\frac{a+b}{5}$,
进而计算A的转化率,再根据K=$\frac{{c}^{2}(C)}{{c}^{2}(A)×c(B)}$=$\frac{{n}^{2}(C)}{{n}^{2}(A)×n(B)}$×V计算;
(3)①恒温恒压下,通入少量B能使平衡正向移动并能提高A转化率,导致体系中A的体积分数减小,若要使A的体积分数再变至与原平衡状态x相同,可通入适量A,或给体系升温使平衡逆向移动;
②若起始时a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与平衡状态A相同,为等效平衡,恒温恒压下,按化学计量数完全转化到左边满足n(A):n(B)=2:1;
③若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态x相同,按化学计量数完全转化到左边满足n(A)=4mol、n(B)=2mol,要使反应开始时向逆方向进行,则c应大于原平衡时C的物质的量,A、B为0时,可以确定c的最大值.
解答 解:(1)若将4mol A和2mol B在2L的容器中混合,经2s后测得C的浓度为0.6mol/L,由方程式可知△c(A)=△c(C)=0.6mol/L,v(A)=$\frac{0.6mol/L}{2s}$=0.3mol/(L.s);
△c(B)=$\frac{1}{2}$△c(C)=0.3mol/L,2s时物质B的浓度=$\frac{2mol}{2L}$-0.3mol/L=0.7mol/L,
故答案为:0.3mol/(L.s);0.7;
(2)设参加反应的B为xmol,则:
2A(g)+B(g)?2C(g)
起始量(mol):a b 0
变化量(mol) 2x x 2x
平衡量(mol)a-2x b-x 2x
达到平衡时它们的物质的量满足:n(A)+n(B)=n(C),即a-2x+b-x=2x,解得x=$\frac{a+b}{5}$,
所以A的转化率=$\frac{2×\frac{a+b}{5}mol}{amol}$×100%=$\frac{2(a+b)}{5a}$×100%;
平衡常数K=$\frac{{c}^{2}(C)}{{c}^{2}(A)×c(B)}$=$\frac{{n}^{2}(C)}{{n}^{2}(A)×n(B)}$×V=$\frac{(2×\frac{a+b}{5})^{2}}{(a-2×\frac{a+b}{5})^{2}×(b-\frac{a+b}{5})}$×2=$\frac{40(a+b)^{2}}{(3a-2b)^{2}×(4b-a)}$,
故答案为:$\frac{2(a+b)}{5a}$×100%;$\frac{40(a+b)^{2}}{(3a-2b)^{2}×(4b-a)}$;
(3)①在达到平衡状态A的容器中再通入少量B,瞬间增大B气的浓度,能使平衡正向移动并能提高A转化率,导致体系中A的体积分数减小,若要使A的体积分数再变至与原平衡状态x相同,可通入适量A,或给体系升温使平衡逆向移动;
故答案为:减小;通入适量A、给体系升温;
②若起始时a=1.2mol,b=0.6mol,二者物质的量之比等于起始时加入的4mol A和2mol B的物质的量之比,而C转化得到的A与B的物质的量之比也是2:1,则c≥0按化学计量数完全转化到左边满足n(A):n(B)=2:1,建立的平衡一定为等效平衡,
故答案为:c≥0;
③设原平衡中消耗的B为xmol,则:
2A(g)+B(g)?2C(g)
起始(mol):4 2 0
变化(mol):2x x 2x
平衡(mol):4-2x 2-x 2x
则(4-2x)+(2-x)+2x=4.2,解得x=1.8,故原平衡时C为3.6mol,
达到平衡后各气体的物质的量与平衡状态x相同,按化学计量数完全转化到左边满足n(A)=4mol、n(B)=2mol,要使反应开始时向逆方向进行,则c>3.6,A和B的量均为0,c有值最大时,4molA、2molB完全转化可以得到4mol C,故3.6<c≤4,
故答案为:3.6<c≤4.
点评 本题考查化学平衡计算与影响因素、化学反应速率计算、等效平衡问题,关键是理解掌握等效平衡规律,难度较大,侧重考查学生计算能力、分析解决问题的能力,需要学生具备扎实的基础,难度较大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:解答题
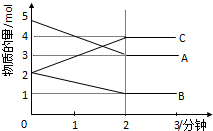 某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:
某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
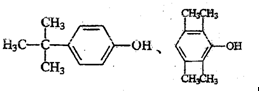 .
.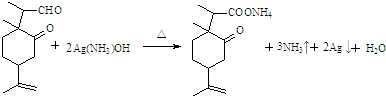 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com