
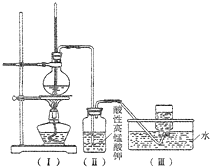
 如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.
如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.分析 (1)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体;
(2)浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,说明浓硫酸氧化乙醇生成碳,同时自身被还原,制得的乙烯气体中通常会含有CO2、SO2等气体,二氧化硫和高锰酸钾能发生氧化还原反应,高锰酸钾溶液褪色;
(3)硫酸酸化的高锰酸钾溶液中本身就含有SO42-,利用二氧化硫具有漂白性能使品红褪色检验二氧化硫存在;
(4)氢氧化钠溶液可除掉二氧化硫.
解答 解:(1)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,反应的化学方程式为:CH3CH2OH$\frac{\underline{\;浓硫酸\;}}{170℃}$CH2=CH2↑+H2O,故答案为:CH3CH2OH$\frac{\underline{\;浓硫酸\;}}{170℃}$CH2=CH2↑+H2O;
(2)浓硫酸具有强氧化性,能氧化乙醇,把乙醇氧化成碳,同时自身被还原成二氧化硫,二氧化硫与高锰酸钾反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4褪色,乙烯被高锰酸钾溶液氧化5CH2=CH2+12KMnO+18H2SO4→10CO2+12MnSO4+28H2O+6K2SO4,导致高锰酸钾溶液褪色;
A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是二氧化硫与高锰酸钾反应,故A错误;
B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,可能是乙烯被高锰酸钾氧化,故B错误;
C.能使高锰酸钾褪色的有二氧化硫和乙烯,所以不能证明通入的气体是纯净物,故C正确;
D.无论是二氧化硫,还是乙烯,使高锰酸钾褪色,都是与高锰酸钾发生氧化还原反应,且高锰酸钾是氧化剂,气体是还原剂具有还原性,故D正确;
故答案为:乙;CD;
(3)装置(Ⅱ)中装有经硫酸酸化的高锰酸钾溶液,酸化引入硫酸根离子,加入盐酸和氯化钡溶液,产生白色沉淀,不能说明是二氧化硫被高锰酸钾氧化所得,改进实验方案证明乙烯中是否含有SO2,可以用二氧化硫具有漂白性,能使品红褪色进行检验,方法是将(Ⅱ)瓶中溶液换成品红溶液,
故答案为:不可靠;硫酸酸化的高锰酸钾溶液中本身就含有SO42-;将(Ⅱ)瓶中溶液换成品红溶液;
(4)氢氧化钠溶液可除掉二氧化硫,溴的四氯化碳溶液褪色可证明乙烯能发生加成反应,故答案为:将(Ⅱ)瓶中溶液换成氢氧化钠溶液,将装置(Ⅲ)换成盛有溴的四氯化碳溶液的洗气瓶.
点评 本题考查了实验室制乙烯法产物的检验,掌握相关物质的基本化学性质是解答本题的关键,(2)硫酸根离子的检验是该题的易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑥⑦⑧ | B. | ②④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ③④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中不含离子键 | |
| B. | 凡是金属元素跟非金属元素化合形成离子化合物 | |
| C. | 离子化合物中的阳离子都是金属离子 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
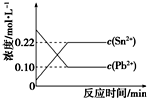 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| C. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
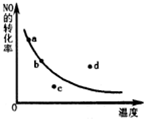 已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com