

分析 A中浓盐酸和二氧化锰在加热条件下制备氯气,B为饱和食盐水,用于除去HCl,C为浓硫酸,用于干燥氯气,D中加热条件下反应生成氯化铜,E为浓硫酸,可防止空气中的水蒸气进入D中,F为氢氧化钠溶液,可吸收氯气,防止污染空气;
另取纯净CuCl2固体用于制备CuCl,应先将氯化铜溶液盐酸中,以防止铜离子水解而导致溶液浑浊,然后通入二氧化硫,发生氧化还原反应可生成CuCl,注意氯离子浓度不能过大,防止生成CuCl32-,以此解答该题.
解答 解:(1)石棉绒的作用是增大铜粉与氯气反应的接触面积;氯气有毒,所以B装置是吸收尾气,而氯气用氢氧化钠吸收,E为浓硫酸,可防止空气中的水蒸气进入D中,F为氢氧化钠溶液,可吸收氯气,防止污染空气,可用装有碱石灰(或生石灰)的干燥管代替,
故答案为:增大铜粉与氯气的接触面积;饱和NaCl溶液; 装有碱石灰(或生石灰)的干燥管;
(2)当Cl2排尽空气后,加热A,铜与氯气反应生成氯化铜,化学反应方程式为Cu+Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,
故答案为:Cu+Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜中的一种或两种,也可能混有石棉绒,故答案为:石棉绒(Cu或CuCl);
(4)因为氯化铜是强酸弱碱盐,溶液中存在Cu2++2H2O?Cu(OH)2+2H+,所以溶解时加入HCl溶液,抑制氯化铜的水解,
故答案为:Cu2++2H2O?Cu(OH)2+2H+,加酸抑制Cu2+的水解;
(5)设9.8mol/LH2SO4的体积为VmL,则0.2×0.1+V×9.8×2=10×0.1,解之得V=50ml,体系中存在平衡2Cl- (aq)+CuCl(s)?CuCl32- (aq),是氯离子的浓度过大平衡正向移动,
故答案为:50;c(Cl-) 过大.
点评 本题考查物质的制备实验方案,为高考常见题型,侧重于基础知识的综合应用以及学生的实验能力的考查,题目涉及盐的水解平衡的应用,尾气处理以及反应方程式的书写等,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 放热的反应发生时不必加热 | |
| B. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应在常温下一定很容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
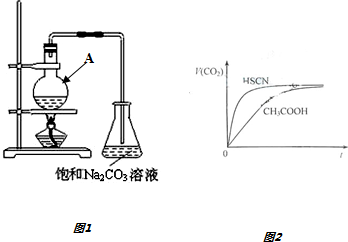
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率 (%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性 (%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
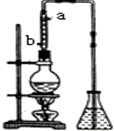 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$n(C2H4O)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
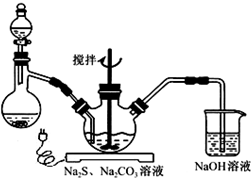 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: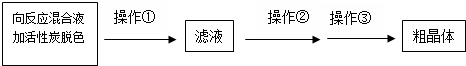
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO21 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com