
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有____________________________。
(2)已知MgO的晶体结构属于NaCl型,某同学画出的MgO晶胞结构示意图如图所示,请改正图中错误:__________________________。

(3)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:
___________________________________________
___________________________________________。
(4)人工模拟酶是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当结合NNR′OHO或Cu(I)(I表示化合价为+1)时,分别形成a和b:

①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异_________________。
解析 (1)以MgCl2为原料用熔融盐电解法制备Mg时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外,还有增大离子浓度,增大熔融盐导电性等作用。
(2)根据NaCl晶体中阴、阳离子的空间位置关系,可判断出实心球应为Mg2+,空心球则为O2-,8号空心球应为实心球。
(3)SiF4晶体为分子晶体,NaF、MgF2则为离子晶体,分子晶体的熔点较低,离子晶体熔点较高,所以SiF4的熔点远低于NaF、MgF2的熔点。而NaF、MgF2两种晶体中,由于r(Mg2+)<r(Na+),且一个Mg2+带2个正电荷,而一个Na+只带1个正电荷,所以MgF2中离子键强度大于NaF中的,从而导致MgF2熔点高于NaF。
(4)①由于σ键为轴对称,可以旋转,不易断裂,而π键属于镜面对称,不可旋转,易断裂,所以该键属于σ键。②a分子中有典型的氢键,而b分子中有典型的配位键。
答案 (1)增强熔融盐的导电性
(2)空心球应为O2-,实心球应为Mg2+;8号空心球改为实心球
(3)NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2的熔点远比SiF4的熔点高。又因为Mg2+的半径小于Na+的半径,Mg2+的电荷较高,所以MgF2的离子键强度大于NaF的离子键强度,故MgF2的熔点大于NaF的熔点
(4)①σ ②a中存在分子间氢键和范德华力,b中存在配位键


科目:高中化学 来源: 题型:
下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH 的浓度增大
的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨温度控制在500 ℃左右
查看答案和解析>>
科目:高中化学 来源: 题型:
用洁净的铂丝蘸取某种无色溶液,在无色火焰上灼烧,火焰呈黄色,说明该溶液中( )
A.只有Na+ B.可能有Na+,可能有K+
C.一定有K+ D.一定有Na+,也可能有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
关于晶体的下列说法正确的是( )
A.化学键都具有饱和性和方向性
B.晶体中只要有阴离子,就一定有阳离子
C.氢键具有方向性和饱和性,也属于一种化学键
D.金属键由于无法描述其键长、键角,故不属于化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.1个甘氨酸分子中存在9对共用电子
B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
查看答案和解析>>
科目:高中化学 来源: 题型:
类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是( )
A.煤、石油和天然气都属于碳素燃料
B.发展太阳能经济有助于减缓温室效应
C.太阳能电池可将太阳能直接转化为电能
D.目前研究菠菜蛋白质“发电”不属于太阳能文明
查看答案和解析>>
科目:高中化学 来源: 题型:
某人设想利用下述反应的联合与循环来生产能解决目前环境和能源问题的某种气体:
3FeCl2+4H2O(g) Fe3O4+6HCl+H2
Fe3O4+6HCl+H2
2Fe3O4+3Cl2+12HCl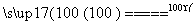 6FeCl3+6H2O+O2
6FeCl3+6H2O+O2
6FeCl3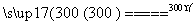 6FeCl2+3Cl2↑
6FeCl2+3Cl2↑
据此请回答:
(1)该人欲生产的这种气体是________。
(2)若生产条件和设备均很理想,在生产过程中只需添加的原料是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生设计了如下三个实验方案,用以检验淀粉的水解程度:
方案A:淀粉溶液 水解液
水解液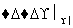 无银镜现象
无银镜现象
结论:淀粉没有水解。
方案B:淀粉溶液 水解液
水解液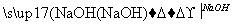 中和液
中和液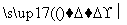 溶液变蓝
溶液变蓝
结论:淀粉没有水解。
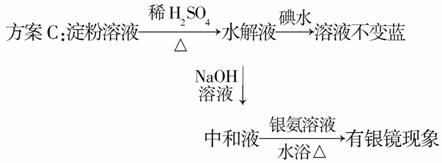
结论:淀粉完全水解。
上述三个方案设计和结论是否正确?并简述理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
向10 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL。下列叙述正确的是( )
A.x=10时,溶液中有NH 、Al3+、SO
、Al3+、SO ,且c(NH
,且c(NH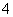 )>c(Al3+)
)>c(Al3+)
B.x=10时,溶液中有NH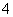 、AlO
、AlO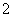 、SO
、SO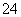 ,且c(NH
,且c(NH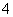 )>c(SO
)>c(SO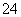 )
)
C.x=30时,溶液中有Ba2+、AlO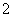 、OH-,且c(OH-)<c(AlO
、OH-,且c(OH-)<c(AlO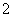 )
)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com