
【题目】VIA 元素的各种性质可归纳整理如下:

回答下列问题:
(1)碲(Te)的氧化物分子式是____________________。
(2)硒酸与碲酸酸性较强的是____________________(填化学式)。
(3)比较键能:H—S H—Se(填“>”或“<”)。
(4)氢硒酸放在空气中,可能发生反应的化学方程式为______________________________。
(5)下图所示为 VIA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示VIA 族中某一元素的单质,下图为相同物质的量的单质与 H2反应过程中的体系温度变化。

则:c 代表__________。(均写单质名称)
【答案】(1)TeO2、TeO3(2)H2SeO4(3)>
(4)2H2Se +O2= 2H2O + 2Se↓ (5)硒
【解析】试题分析:(1)碲(Te)是第ⅥA元素,与它同族的硫元素的氧化物有SO2和SO3,则Te的氧化物分子式是TeO2、TeO3。
(2)硒和碲属于同主族元素,同主族元素从上到下,非金属性逐渐减弱,最高价氧化物的水化物酸性逐渐减弱,所以硒酸与碲酸酸性较强的是H2SeO4。
(3)原子半径越小,共价键的键长越短,键能越大,则键能H—S > H—Se。
(4)氢硒酸易失电子而具有还原性,易被空气氧化生成Se单质,则氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se +O2= 2H2O + 2Se↓。
(5)同主族元素从上到下,非金属性逐渐减弱,与氢气化合的难度逐渐增大,所以第ⅥA元素的单质与氢气化合的越来越难,所以a、b、c分别为氧、硫、硒,c代表硒。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列有关叙述正确的是
A.14g乙烯和丙烯混合气体中的氢原子数为2 NA
B.1molFe溶于过量硝酸,电子转移数为2NA
C.18g水中含有2NA个氢键
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)△H<0,是工业制硫酸的主要反应之一。
2SO3(g)△H<0,是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如图所示:

E的大小对该反应的反应热有无影响_______ (填“有”或“无”),该反应通常有V2O5作催化剂,加入V2O5后,改变的是图中的_____。
A.△H B.E C.△H-E D.△H+E
(2)某温度下,甲同学将2molSO2和1molO2置于密闭容器中,反应达平衡后,SO2平衡转化率(α)与体系总压强(p)的关系如图①所示,若A点二氧化硫的平衡浓度为0.04mol/L,则容器的体积为__L;图①中B点SO2、O2、SO3的平衡浓度之比为_________;反应达到平衡时,时间t1时缩小容器体积,请在图②中画出时间t1之后反应速率变化图像;图③为压强等于0.5MPa时不同温度下SO2转化率与温度关系图,图中T2___T1(填写“大于”或“小于”)

(3)在2L的密闭容器中,乙同学投入2molSO2和bmolO2;25min时达到平衡,如下图所示,在35min时,改变某一条件,经过一段时间后,70min时,反应再次达到平衡,回答下列问题:

①10min时,v(SO2) ______
②求0~10min时,v(O2)=_______
③反应开始至35min时,测得反应共放热138.6kJ,则反应2SO2(g)+O2(g)==2SO3(g)△H=_________kJ/mol
④35min时,改变的条件可能是______
A.加入更多的V2O5
B.从容器中分离出少量O2
C.投入一定量的SO3
D.降低反应温度
E.往容器中加入N2,使容器压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 对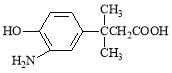 的表述不正确的是
的表述不正确的是
A.该物质能发生缩聚反应
B.该物质的核磁共振氢谱上共有7个峰
C.该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应
D.1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。

①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氮气一定条件下反应生成氨气。已知 H-H 键、N≡N、H-N 键能分别为Q1、Q2 、Q3 kJmol-1。下列关系式中正确的是
A.3Q1 + 3Q2 < 2Q3
B.Q1+Q2 < Q3
C.3Q1 + Q2 < 6 Q3
D.3Q1 + Q2 < 2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池的总反应为:2CH3OH +3O2= 2CO2 ↑+ 4H2O,下图是该电池的示意图。下列说法正确的是
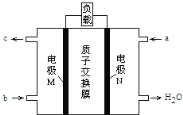
A.a 是氧气,b 是甲醇
B.质子从 N 电极区穿过质子交换膜移向 M 电极区
C.正极反应为:O2 +2H2O + 4e- = 4 OH-
D.当电路中有 3 mole- 转移时,电池中n(H+)变化为 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能 B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为 (用元素符号表示)。
(2)D元素原子的价电子排布式是 。
(3)C元素的电子排布图为 ;E3+的离子符号为 。
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 。
(5)G元素可能的性质 。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com