
分析 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,以此来解答.
解答 解:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,则HNO3是氧化剂;Cu是还原剂;Cu失去电子被氧化,则是Cu(NO3)2氧化产物;N得到电子被还原,NO是还原产物,被还原的HNO3与未被还原的HNO3物质的量之比是2:6=1:3,
故答案为:HNO3;Cu;Cu(NO3)2;NO;1:3.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意硝酸作酸和氧化剂,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 测定它的碳、氢元素的质量比 | |
| B. | 只要证明它完全燃烧后产物有H2O和CO2 | |
| C. | 测定其产物中H2O和CO2的比值 | |
| D. | 测定该试样质量及试样完全燃烧后产物的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解 | |
| D. | 海带灼烧成灰烬后,加水煮沸2~3min并过滤,滤液中可加入适量的H2O2来氧化I? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插A硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 盐酸滴入澄清石灰水:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 将金属Na加入冷水中:2Na+2H2O═2Na+++2OH-+H2↑ | |
| D. | 向含0.5molFeBr2的溶液中通入0.5molC12:2Fe2++C12═2Fe3++2C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
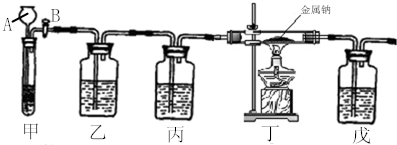
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
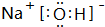 .
.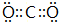 .属非极性分子(填分子极性).EC2其固体属原子晶体.
.属非极性分子(填分子极性).EC2其固体属原子晶体.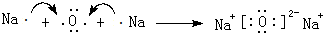 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
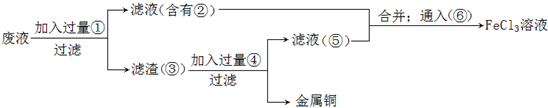
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CH4的电极为正极 | |
| B. | 放电时溶液中的阳离子向负极移动 | |
| C. | 负极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 通入CH4的电极反应式为:CH4+2O2+4e-═CO2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com