
【题目】如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制95mL 1mol·L-1的稀硫酸。
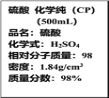
可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,除玻璃棒外还缺少的仪器是__(写仪器名称);
(2)经计算,配制95mL 1mol·L-1的稀硫酸,需要用量筒量取上述浓硫酸的体积为__mL,量取硫酸时应选用___mL规格的量筒(填序号);
A.10mL B.50mL C.100mL D.200mL
(3)取25mL 1mol·L-1的硫酸,向其中加入一定量的氧化铜,充分反应后制得硫酸铜溶液。用该溶液制取CuSO4·5H2O,所需要的主要玻璃仪器除酒精灯、玻璃棒外,还缺少的仪器是___;
(4)对所配制的稀硫酸进行测定,发现其浓度大于1mol·L-1,配制过程中下列各项操作可能引起该误差的原因___(填序号)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
【答案】100mL的容量瓶 5.4 A 烧杯、漏斗 ACE
【解析】
(1)用浓硫酸配制稀硫酸的实验步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,根据该实验步骤确定缺少的仪器;
(2)根据稀释定律:稀释前后溶质物质的量不变,计算所需浓硫酸的体积;量取硫酸时应依据“大而近”的原则选择量筒;
(3)用硫酸铜溶液制取CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,据此判断所需仪器;
(4)根据公式![]() ,判断操作不当对于溶质物质的量、溶液体积的影响,从而判断对浓度的影响。
,判断操作不当对于溶质物质的量、溶液体积的影响,从而判断对浓度的影响。
(1)用浓硫酸配制稀硫酸的实验步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,根据该实验步骤可知所需的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶和胶头滴管,结合已知的可用仪器可知,除玻璃棒外还缺少的仪器是100mL容量瓶;
故答案为:100mL的容量瓶;
(2)根据稀释定律可知稀释前后溶质物质的量不变,则V×1.84g/cm3×98%=0.1L×1mol·L-1×98g/mol,解得V=5.4mL,量取硫酸时应选用10mL规格的量筒;
故答案为:5.4;A;
(3)用硫酸铜溶液制取CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则所需要的主要玻璃仪器除酒精灯、玻璃棒外,还缺少的玻璃仪器是烧杯、漏斗;
故答案为:烧杯、漏斗;
(4)A.用量筒量取浓硫酸时,仰视刻度线,量取的浓硫酸偏大,则溶质物质的量偏大,结果浓度偏大;
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,无影响;
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作,未进行冷却,则加入的蒸馏水偏少,则溶液的体积偏小,造成浓度偏大;
D.转移溶液时,不慎有少量溶液洒到容量瓶外面,溶质损失,则浓度偏小;
E.定容时,俯视容量瓶刻度线进行定容,加入的蒸馏水体积偏小,则浓度偏大;
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,加入的蒸馏水体积偏大,浓度偏小;
综上所述:ACE会使得所配置的溶液的浓度偏大;
故答案为:ACE。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个O2,含分子数最多的是______(填序号,下同),含电子数最多的是______,质量最大的是______,体积最小的是______;密度由小到大的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr (OH)3、H2O、H2O2。 已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是______________。
(2)该反应中,发生还原反应的过程是________→________。
(3)写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:__________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在银圈和铁圈之间用铂丝连接,联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液。
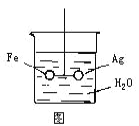
(1)片刻后可观察到的现象是__________________
(2)产生上述现象的原因是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g) △H<0,若在恒压绝热的容器中发生,下列选项表明一定已达平衡状态的是
2NH3(g) △H<0,若在恒压绝热的容器中发生,下列选项表明一定已达平衡状态的是
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2 和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250-300℃时,温度升高而乙酸的生成速率降低的主要原因是因为催化剂的催化效率降低
C. 由300-400℃可得,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大。
D. 根据图像推测,工业上若用上述反应制备乙酸最适宜的温度应为400℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二乙酸![]() 环己二醇酯可通过下列路线合成:
环己二醇酯可通过下列路线合成:

(1)属于取代反应的是______,属于加成反应的是______(填序号).
(2)A的结构简式为______.
(3)写出反应④、⑦的化学方程式:______、______.
(4)分子式为C4H8BrCl的有机物共有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
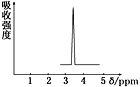
(1) 化合物A和B的分子式都是C2H4Br2,A的核磁共振谱图如图所示,则A的结构简式为____________________,请预测B的核磁共振谱上有______个峰(信号)
(2) 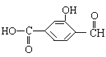 中含有的官能团的名称为_________、__________、__________。
中含有的官能团的名称为_________、__________、__________。
(3) 在戊烷的各种同分异构体中,核磁共振氢谱只有一个吸收峰的结构简式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com