
| A. | 14g CO2 | B. | 1lg CO2、3g CO | C. | CO、CO2各7g | D. | 14g CO |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
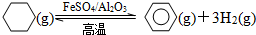
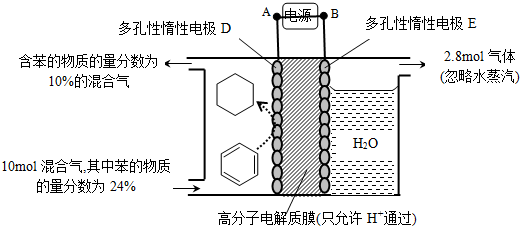
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2是还原剂,发生氧化反应 | |
| B. | FeSO4是还原产物 | |
| C. | 每生成1molH2SO4,转移14mol电子 | |
| D. | 反应中H2O既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3 中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+H2O═H2SiO3↓+2HCO3- | |
| C. | 向Al2(SO4)3 溶液中加入过量NH3•H2O:Al3++4NH3.H2O═AlO2-+4NH4++2H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | B | C | D | |
| X | FeCl2溶液 | FeCl2溶液 | Fe | FeSO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Fe2(SO4)3 |
| Z | Cl2 | Fe | NaOH溶液 | Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3是一种酸性氧化物 | |
| B. | 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 | |
| C. | 分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为 3:2:3 | |
| D. | 明矾属硫酸盐,含结晶水,是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
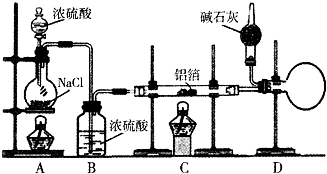 无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾.氯化铝还易溶于乙醇、氯仿和四氯化碳.实验室可用反应2Al+6HCl(g)$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾.氯化铝还易溶于乙醇、氯仿和四氯化碳.实验室可用反应2Al+6HCl(g)$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2制备少量无水氯化铝,某同学利用该原理设计如下实验装置:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com