
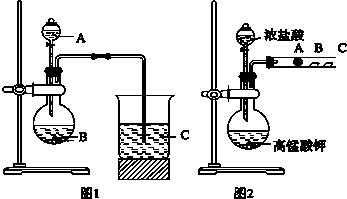
分析 (1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;
(2)依据强酸制弱酸来设计反应,所以A为硝酸,B为碳酸钙,C为硅酸钠溶液;
(3)图1烧杯中为二氧化碳与硅酸钠反应,根据发生的反应来书写离子方程式;
(4)硝酸易挥发,避免干扰,所以为吸收挥发出来的硝酸,应在B和C之间增加一个洗气装置盛放饱和的碳酸氢钠;
(5)NaBr溶液的棉花与氯气反应生成单质溴,所以棉花由白色变为橙黄色,B处湿润淀粉KI试纸中的碘离子与氯气反应生成单质碘,反应的离子方程式为:2I-+Cl2=2Cl-+I2;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,过量的氯气逸出,溴挥发,碘升华,所以最后得到NaCl和KCl;
(6)反应中只能证明氯气比Br2和I2的氧化性强,但不能验证Br2和I2的氧化性强弱.
解答 解:(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硫酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应,故答案为:强酸制弱酸;
(2)依据强酸制弱酸来设计反应,所以A为硝酸,B为碳酸钙,C为硅酸钠溶液,故答案为:HNO3;CaCO3;Na2SiO3;
(3)图1烧杯中为二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-,故答案为:CO2+SiO32-+H2O=H2SiO3↓+CO32-或2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-;
(4)硝酸易挥发,避免干扰,所以为吸收挥发出来的硝酸,应在B和C之间增加一个洗气装置盛放饱和的碳酸氢钠,故答案为:碳酸氢钠;吸收挥发出来的硝酸,避免干扰;
(5)NaBr溶液的棉花与氯气反应生成单质溴,所以棉花由白色变为橙黄色,B处湿润淀粉KI试纸中的碘离子与氯气反应生成单质碘,反应的离子方程式为:2I-+Cl2=2Cl-+I2;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,过量的氯气逸出,溴挥发,碘升华,所以最后得到NaCl和KCl;故答案为:棉花由白色变为橙黄色;2I-+Cl2=2Cl-+I2;NaCl和KCl;
(6)反应中只能证明氯气比Br2和I2的氧化性强,但不能验证Br2和I2的氧化性强弱,故答案为:不合理;不能验证Br2和I2的氧化性强弱.
点评 本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,具有较强的综合性,有一定的难度,注意实验设计的原理和方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg在CO2中燃烧生成MgO和C,是放热反应 | |
| B. | 工业上通过电解MgCl2溶液制取金属镁 | |
| C. | Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率 | |
| D. | 镁可以用来制造信号弹和焰火,MgO可以作耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O在高温下也难分解 | |
| B. | F2、Cl2、Br2、I2单质的熔点依次升高 | |
| C. | SiH4的熔点高于CH4的熔点 | |
| D. | NH3的沸点高于PH3的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
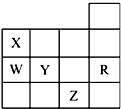 如图为元素周期表前四周期的一部分,下列 有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列 有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )| A. | 常压下5种元素的单质中Z单质的沸 点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | W的氢化物的还原性比Y的氢化物的还原性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 性质或结构信息 |
| A | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
| B | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍 |
| C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
| D | +2价阳离子的核外电子排布与氖原子相同 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色 | |
| B. | 在一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成 | |
| C. | 在一定条件下,苯与氢气反应生成环己烷 | |
| D. | 在催化剂作用下,乙烯与水反应生成乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com