
| A. | 1.8g重水(D2O)中含有的中子数为NA | |
| B. | 1molCl2参加氧化还原反应,转移的电子数一定为2NA | |
| C. | T℃时pH=6的纯水中,含有10-6 NA个OH- | |
| D. | 电解精炼铜时,若转移NA个电子,阴极析出32 g铜 |
分析 A.重水的摩尔质量为20g/mol,1.8g重水的物质的量为0.09mol,1个重水中含有10个中子;
B.氯气参加反应转移电子数与氯气表现性质有关;
C.水的体积未知;
D.32g铜的物质的量为0.5mol,得到0.5mol铜需要转移1mol电子.
解答 解:A.1个重水中含有10个中子,重水的摩尔质量为20g/mol,1.8g重水的物质的量为0.09mol,含有中子数为0.9NA,故A错误;
B.氯气参加反应,表现性质不同,转移电子数不同,例如氯气与水反应生成盐酸和次氯酸,Cl元素的化合价由0升高为+1价,Cl元素的化合价由0降低为-1价,1mol Cl2参加反应转移电子数为NA,故B错误;
C.水的体积未知;无法计算微粒个数,故C错误;
D.根据电子守恒,转移电子数为NA,生成0.5mol铜,质量为32g,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确电解法精炼铜原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
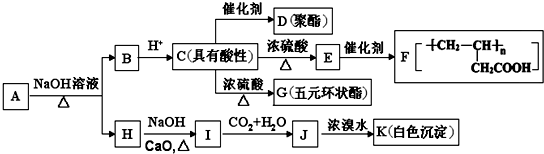
 +NaOH$→_{△}^{CaO}$R-H+Na2CO3
+NaOH$→_{△}^{CaO}$R-H+Na2CO3 ,K的结构简式为
,K的结构简式为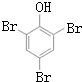 .
.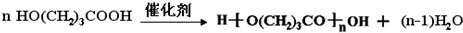 ;
;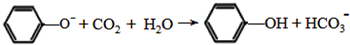 .
. (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
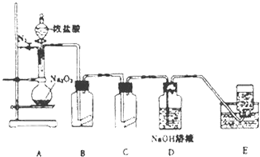 氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16 g O2和32g O3的混合物中,含有O原子数目为3NA | |
| B. | 标准状况下,1 mol Na2O和1 mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为$\frac{5}{3}$NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
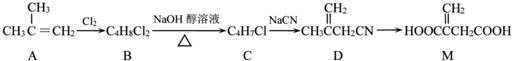
 +NaOH$→_{△}^{乙醇}$
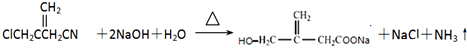
+NaOH$→_{△}^{乙醇}$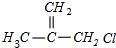 +NaCl+H2O,其反应类型为消去反应.
+NaCl+H2O,其反应类型为消去反应.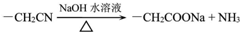 ,D经五步转成变成M的合成反应流程为:
,D经五步转成变成M的合成反应流程为: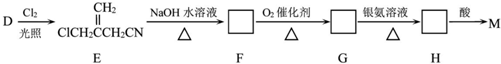
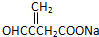 ;
; ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
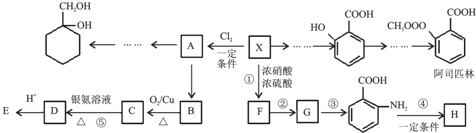
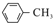 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$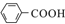
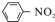 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$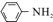 (苯胺,易被氧化)
(苯胺,易被氧化) ,分子中最多有13个原子共面.
,分子中最多有13个原子共面. .
. .
.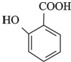 有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式
有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式 .
.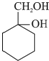 最合理的方案.在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件.
最合理的方案.在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com