
元素周期律:随着原子序数的递增,元素及其化合物的性质呈周期性的变化.
同一周期元素性质的变化规律:________.
同一主族元素性质的变化规律:________.
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:
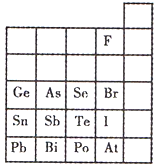 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、KOH、RbOH的碱性逐渐减弱 | B、CH4比SiH4的化学性质稳定,所以碳元素的非金属性比硅元素弱 | C、元素周期律是元素原子核外电子排布随着相对原子质量的递增发生周期性变化的必然结果 | D、砹单质为有色固体,可能易溶于某些有机溶剂,HAt不稳定,AgAt不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的性质随着原子序数的递增而呈周期性变化 | B、元素性质周期性变化的本质是原子核外电子排布的周期性 | C、从左到右,同周期主族元素的金属性依次减弱,非金属性依次增强 | D、同周期主族元素原子半径从左到右依次增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com