
【题目】现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:________________________。正极:________________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)。

(3)Cu2+、Fe3+的氧化性由强到弱的顺序为:___________。
(4)该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的物质的量是_________。
【答案】
(1)Cu -2e- = Cu2+,2Fe3+ +2e- =2Fe2+;
(2)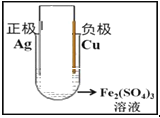 ;
;
(3)Fe3+﹥Cu2+;
(4)0.1 mol。
【解析】
试题分析:(1)验证Cu2+、Fe3+氧化性的强弱,原理是Cu+2Fe3+=Cu2++2Fe2+,根据原电池的工作原理,Cu作负极,其电极反应式为Cu-2e-=Cu2+,纯银片作正极,其反应式为Fe3++e-=Fe2+;(2)电子从负极经外电路流向正极,其装置图为: ;(3)根据总电极反应式,氧化剂的氧化性大于氧化产物的氧化性,Fe3+>Cu2+;(4)溶液增加的量为Cu的质量,根据负极电极反应式,转移电子的物质的量为3.2×2/64mol=0.1mol。
;(3)根据总电极反应式,氧化剂的氧化性大于氧化产物的氧化性,Fe3+>Cu2+;(4)溶液增加的量为Cu的质量,根据负极电极反应式,转移电子的物质的量为3.2×2/64mol=0.1mol。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图中所列装置是用燃烧法确定有机物分子式常用的装置。

回答下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是____。
(2)C装置中浓硫酸的作用是________。
(3)若准确称取7.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加22g,B管质量增加10.8g,则该有机物的实验式为____。
(4)要确定该有机物的分子式,则 (“是”或“不”)需要测定其他数据;若能确定其分子式,其一氯代物只有一种,则其结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 ( )
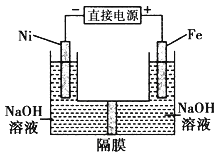
A.铁是阳极,电极反应为 Fe-6e一+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜, 则电解结束后左侧溶液中含有FeO42-
D.电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
![]()
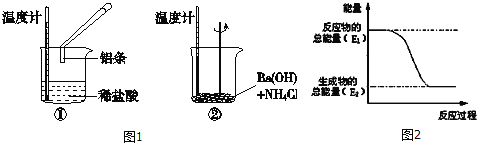
请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是 热反应,Ba(OH)28H2O与NH4Cl的反应是 热反应.反应过程 (填“①”或“②”)的能量变化可用图2表示.
(2)现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
①以上两个反应能设计成原电池的是
②写出设计原电池正、负极电极反应式 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从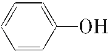 合成
合成 (部分试剂盒反应条件已略去):
(部分试剂盒反应条件已略去):
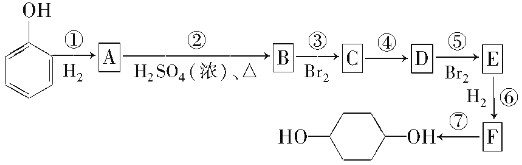
请回答下列问题:
(1)分别写出B、D的结构简式:
B.__________________________________________________,
D.__________________________________________________。
(2)反应①~⑦中属于消去反应的是_________。属于还原反应的是 (填反应代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到E的可能的结构简式为: ____________________________________________________。
(4)试写出C―→D反应的化学方程式(有机物写结构简式,并注明反应条件)。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下是电解CuCl2溶液的装置,其中c、d为石墨电极,请填写下列空格:

(1)C电极是 极,发生反应的是 (填微粒符号),该微粒在反应中 电子(“得”或“失”),发生 反应(“氧化”或“还原”), 反应现象为 ,电极反应式 。
(2)总方程式为 。
(3)上述电解反应中,被氧化的物质是 ,被还原的物质是 (填化学式)。
(4)在化学反应中发生的能量转化形式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:(填写时用对应元素符号或物质的化学式)
(1)五种元素原子中基态时未成对电子数最多的是 。
(2)基态原子Y的轨道表示式是:![]()
(3)基态原子Z的电子排布式是 。向Z的硫酸盐溶液中加入过量氨水时反应的离子方程式是 ,所得产物中含Z元素在内的离子的结构示意图是:(不考虑空间构型,如有配位键,请标出)
(4)Q、R、X的电负性由小到大的顺序是 。
(5)Q、X和Y的氢化物稳定性由小到大的顺序为 。
(6)在一定条件下,原子的核外电子从激发态跃迁到基态产生的光谱属于 光谱(填“吸收”或“发射”),该光谱可用于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬.
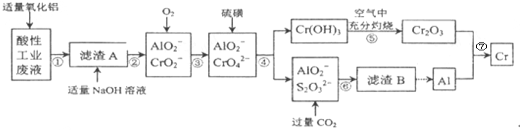
有关数据如表:
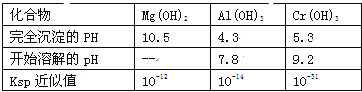
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO47H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。当溶液Ph=5时,c(Cr3+)=__________
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
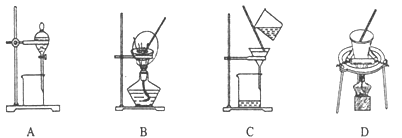
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)
(6)步骤⑦发生的化学反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解 | 苯与氢气(催化剂、加热) |
C | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com