


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、25mL 3 mol?L-1的KCl |
| B、75 mL 1.5 mol?L-1的CaCl2 |
| C、150 mL 1 mol?L-1的NaCl |
| D、100 mL 2 mol?L-1的FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
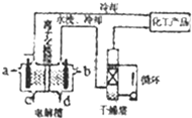 工业上电解饱和食盐水能制取多种化工原料,其设备示意图如图:
工业上电解饱和食盐水能制取多种化工原料,其设备示意图如图: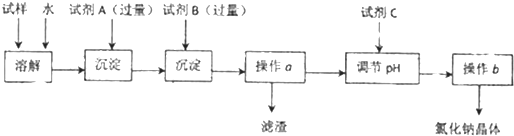
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

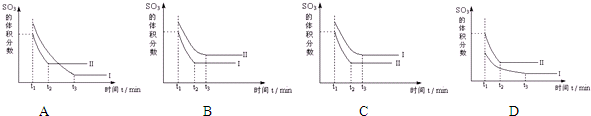
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
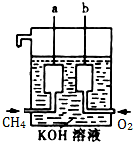 美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a-lg2 |
| B、b-lg2 |
| C、a+lg2 |
| D、b+lg2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com