
科目:高中化学 来源: 题型:
能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。

①完成原电池甲的装置示意图(见上图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是_____________。
④根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在上述的材料中应选__________作阳极。
(2)[2013·北京理综,26(4)]通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
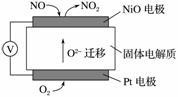
①Pt电极上发生的是________反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知:pM=-lg c(M),p(CO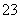 )=-lg c(CO
)=-lg c(CO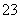 )。下列说法正确的是( )
)。下列说法正确的是( )
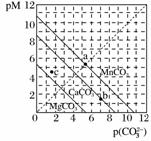
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO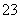 )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO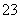 )
)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO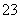 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
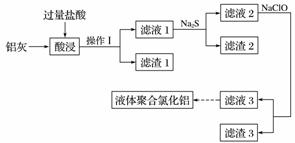
以铝灰(主要成分为Al 、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m-n],生产的部分过程如下图所示(部分产物和操作已略去)。
已知某些硫化物的性质如下表:
| 物质 | 性质 |
| Fe2S3、Al2S3 | 在水溶液中不存在 |
| FeS | 黑色,难溶于水,可溶于盐酸 |
| CuS | 黑色,难溶于水,难溶于盐酸 |
(1)操作Ⅰ是______________。Al2O3与盐酸反应的离子方程式是______________________。
(2)滤渣2为黑色,该黑色物质的化学式是_____________________________________。
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7。NaClO的作用是________________________________________________________________________。
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝。反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
A.直线 sp杂化 B.V型 sp2杂化
C.三角锥形 sp3杂化 D.平面三角形 sp2 杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
N2在诸多领域用途广泛。某化学兴趣小组为探究在实验室制备较为纯净N2的方法,进行了认真的准备。请你参与交流与讨论。
[查阅资料]N2的制法有下列三种方案:
方案1:加热NaNO2和NH4Cl的浓溶液制得N2。
方案2:加热条件下,以NH3还原CuO可制得N2,同时获得活性铜粉。
方案3:将空气缓缓通过灼热的铜粉获得较纯的N2。
[实验准备]以实验室常见仪器(药品)等设计的部分装置如下图(部分夹持和加热仪器未画出)。
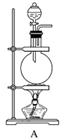
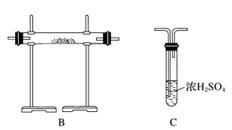

[分析交流]
(1)若以方案1制得N2,应选择的发生装置是___________________________。
(2)若按方案2制得干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料,整套制气装置按气流从左到右的连接顺序是______________(填字母)。获得N2的反应原理是________________________________________________________________________(写反应方程式)。
(3)若以排水法收集N2,其中会混入水蒸气。但也不宜用排空气法,其原因是________________________________________________________________________。
你提出的收集方法是______________________________________。
(4)上述三个方案中,制得的N2纯度最差的是________。在N2纯度要求不甚严格的情况下,有人建议将方案2和方案3结合使用,你认为其优点是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1 min后,测得容器内A的浓度为x mol·L-1。这时B的浓度为______ mol·L-1,C的浓度为______ mol·L-1。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO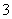 、CO
、CO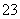 、ClO-结合H+的能力由强到弱的顺序为____________。
、ClO-结合H+的能力由强到弱的顺序为____________。
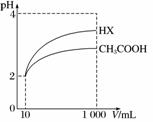
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com