
| 固体活性炭/mol | NO/mol | A/mol | B/mol | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
分析 (1)反应ⅠNO(g)和O3(g)根据盖斯定律,①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ/mol,②2NO(g)+O2(g)═2NO(g)△H=-116.2kJ/mol,得目标反应的反应热等于①+②;
(2)根据△G=△H-T•△S判断反应能否自发进行,如果△G<0,反应能自发进行,△G>0,反应不能自发进行;
(3)①甲酸钠是强碱弱酸盐,水解呈碱性,所以水溶液呈碱性,离子反应方程式表示其原因HCOO-+H2O?HCOOH+OH-;
②向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,得到等物质的量浓度的甲酸、甲酸钠和氯化钠的混合液,以甲酸的电离为主,溶液呈酸性,溶液中离子浓度从大到小的顺序为 c (Na+)>c(HCOO-)>c (Cl-)>c(H+)>c(OH-);
(4)①温度升高平衡逆向移动,所以正反应是放热反应;
②由200℃时,各物质的量关系可知,反应方程式为:2NO?A+B,两边气体的计量数相等,而平衡后向恒容容器中再充入0.1molNO,相当于增大压强,平衡不移动;③平衡常数等于平衡时生成物的浓度幂之积比上反应的浓度幂之积,由此分析解答.
解答 解:(1)反应ⅠNO(g)和O3(g)根据盖斯定律,①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ/mol,②2NO(g)+O2(g)═2NO(g)△H=-116.2kJ/mol,得目标反应的反应热等于①+②,所以I的热化学方程式为3NO(g)+O3(g)═3NO2(g)△H=-317.1 kJ•mol-1,故答案为:3NO(g)+O3(g)═3NO2(g)△H=-317.1 kJ•mol-1;
(2)根据△G=△H-T•△S判断反应能否自发进行,如果△G<0,反应能自发进行,△G>0,反应不能自发进行,2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0,不能实现,
故答案为:否;该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0;
(3)①甲酸钠是强碱弱酸盐,水解呈碱性,所以水溶液呈碱性,离子反应方程式表示其原因HCOO-+H2O?HCOOH+OH-,故答案为:HCOO-+H2O?HCOOH+OH-;
②向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,得到等物质的量浓度的甲酸、甲酸钠和氯化钠的混合液,以甲酸的电离为主,溶液呈酸性,溶液中离子浓度从大到小的顺序为 c (Na+)>c(HCOO-)>c (Cl-)>c(H+)>c(OH-),故答案为:酸; c (Na+)>c(HCOO-)>c (Cl-)>c(H+)>c(OH-);
(4)①温度升高平衡逆向移动,所以正反应是放热反应,故答案为:放热;
②由200℃时,各物质的量关系可知,反应方程式为:2NO?A+B,两边气体的计量数相等,而平衡后向恒容容器中再充入0.1molNO,相当于增大压强,平衡不移动,所以NO的百分含量将不变,故答案为:不变;
③平衡常数等于平衡时生成物的浓度幂之积比上反应的浓度幂之积,所以K=$\frac{\frac{0.025}{2}×\frac{0.025}{2}}{(\frac{0.05}{2})^{2}}$=0.25,故答案为:0.25.
点评 本题是一道关于化学反应能量变化,化学反应速率和化学平衡移动的总合考查题,主要考查了化学平衡移动原理应用,平衡常数计算,考查学生分析和解决问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2P2(g)=P4(g)△H=-229.7 kJ•mol-1 | B. | P2制P4是放热反应 | ||
| C. | P2比P4更加稳定 | D. | 等质量时P2比P4具有的能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe2(SO4)3溶液中加入铁粉:Fe3++Fe═2Fe3+ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | 铜跟浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ |
| PH | 11 | 3 | 3 |
| 溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
| A. | CH3COOH稀溶液中加入少量CH3COONa,能使比值c(CH3COO-)/c(Na+)增大 | |
| B. | ①、②等体积很合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 向②加入NaF固体,CH3COOH电离平衡正向移动 | |
| D. | 中和相同体积的②、③,需消耗①的体积②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )
可逆反应L(s )+aG(g)?bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强Pl>P2.下列判断正确的是( )| A. | 1+a<b | |
| B. | △H<0 | |
| C. | a>b | |
| D. | 增加L的物质的量,可提高G的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
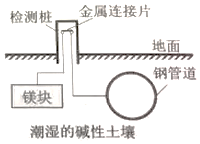
| A. | 该方法是将化学能转化成了电能 | |
| B. | 在此装置中钢管道做负极 | |
| C. | 该方法称为“外加电流阴极保护法” | |
| D. | 镁块上发生的电极反应:O2+2H2O+4e→4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象 | |
| B. | 刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到 | |
| C. | 王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应 | |
| D. | 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com