
【题目】塑料、橡胶等材料的交联剂E的合成路线如图所示:
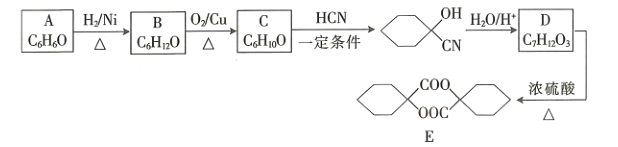
回答下列问题:
(1)B的名称为____________________。
(2)C生成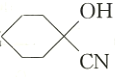 的反应类型是_________________,D中官能团的名称是________________。
的反应类型是_________________,D中官能团的名称是________________。
(3)D生成E的化学方程式为_____________________。
(4)E的同分异构体中符合下列条件的有______________种。(不考虑立体异构)
a.属于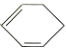 的二取代物
的二取代物
b.取代基处于对位且完全相同
c.能够与![]() 溶液反应产生
溶液反应产生![]()
其中核磁共振氢谱有4组峰,峰面积之比为6:2:1:1的结构简式为_______________。
(5)参照题干中合成路线,设计以丙酮为主要原料制备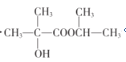 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
【答案】环己醇 加成反应 羟基、羧基 2 +2H2O 10
+2H2O 10 

【解析】
根据后续产物的结构可知A中应含有六元环,再结合A的分子式,可知A为![]() ,与氢气发生加成反应生成B,B为
,与氢气发生加成反应生成B,B为![]() ,羟基发生催化氧化生成C,则C为
,羟基发生催化氧化生成C,则C为![]() ,C与HCN在一定条件反应生成
,C与HCN在一定条件反应生成![]() ;根据D的分子式以及E的结构可知
;根据D的分子式以及E的结构可知![]() 在H2O/H+的条件下-CN转化为-COOH,所以D为
在H2O/H+的条件下-CN转化为-COOH,所以D为 。
。
(1)根据分析可知B为![]() ,其名称为环己醇;
,其名称为环己醇;
(2)C为![]() ,与HCN在一定条件发生加成反应生成
,与HCN在一定条件发生加成反应生成![]() ;
;
(3)根据分析可知D为 ,两分子D发生酯化生成E,方程式为:
,两分子D发生酯化生成E,方程式为:![]() +2H2O;
+2H2O;
(4)E的同分异构体满足:
a.属于 的二取代物
的二取代物
b.取代基处于对位且完全相同,则取代基的可以位于![]() 或
或 ;
;
c.能够与NaHCO3溶液反应产生CO2,说明含有-COOH,则取代基可以是-CH2CH2CH2COOH,或-CH(CH3)CH2COOH,或-CH2CH(CH3)COOH,或-CH(CH2CH3)COOH,或-C(CH3)2COOH,所以共有5×2=10种;其中核磁共振氢谱有5个峰,峰面积之比为6:2:1:1的是: ;
;
(5)对比丙酮CH3COCH3和目标产物的结构特点可知,需要在丙酮的2号碳上引入羟基和羧基,然后再和2-丙醇发生酯化,引入羟基和羧基的过程与C到D的过程类似,丙酮和氢气加成可以生成2-丙醇,所以合成路线为 。/p>
。/p>


科目:高中化学 来源: 题型:
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
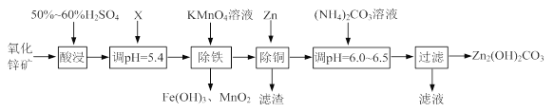
(1)“酸浸”时保持H2SO4过量的目的是_____。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:_____。
②流程中调节pH=5.4所加试剂X为_____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为_____(填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素

(1)表格中最稳定的元素是_____(填元素符号),h在周期表的位置为_____。
(2)元素i的最高价氧化物对应水化物的化学式为_____
(3)c、d、e三种元素对应的原子半径由大到小的顺序为_____(用元素符号表示)
(4)c、h气态氢化物的稳定性强弱关系是_____(用化学式表示)
(5)写出f和i形成的化合物中所含化学键的类型_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中____L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。
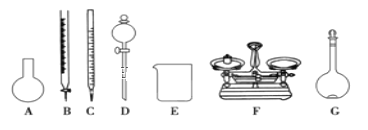
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是_____________,CO的体积分数是_____________,该混合气体对于氢气的相对密度为________ 。
(2) 1.12g金属铁跟某稀盐酸恰好完全反应,得到100mL溶液,试计算:
①生成的气体在标准状况下的体积是_________________
②反应后所得溶液中溶质的物质的量浓度是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。

I.设计方案如下:
| 方案 | 试剂X | 预期现象 |
方案i | 1mL 1 mol/L NaOH溶液 | a | |
方案ii | 1mL 1 mol/L 酸性KMnO4溶液 | b | |
方案iii | 依次加入5滴KSCN溶液、1mL氯水 | c |
(1)方案i的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。产生白色沉淀的离子方程式是_________,最终变为红褐色的化学方程式是________。
(2)方案ii的预期现象是_________。
(3)方案iii的预期现象是________,反应中氯水参与反应的的离子方程式是____。
II.进行实验操作,得到的实际现象如下:
方案 | 实际现象 | 是否与预期现象相同 |
方案i | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
方案ii | 相同 | |
方案iii | 自始至终无明显现象 | 不同 |
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
本品每毫升含主要成分葡萄糖酸亚铁30毫克,
辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。
结合资料对异常现象产生的原因进行猜想:______________;为验证其猜想,在方案iii的基础上继续加入过量的氯水,得到了预期的现象。
(5) 实验反思:方案ii中预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,理由是______。
(6)小组同学进一步提出研究问题:仍选用之前用过的试剂,设计实验验证某久置的补铁口服液(计为Y
实验序号 | 操作 | 现象 |
ⅳ | 取2 mL溶液Y,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
V |
实验V的操作及现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。

(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平的两盘上,分别放有两个质量相同的烧杯,各盛有6 mol·L-1HCl 100 mL,使天平达到平衡。分别向两烧杯中加入不超过5 g 的镁和铝,若要使其充分反应后天平仍保持平衡,则加入的镁与铝的质量之比为( )
A. 1∶1 B. 24∶27 C. 12∶9 D. 32∶33
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com