
| A.配制FeCl3溶液时,为抑制Fe3+的水解,用HCl酸化 |
| B.为抑制Fe2+的水解,用稀硝酸酸化 |
| C.检验溶液中含有Cl-时,用稀硫酸酸化,再检验 |
| D.确认溶液中含有SO42-时,用稀硝酸化,再检验 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类相同 |
| C.c(OH-)前者小于后者 |
| D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数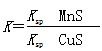 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com