
A.m=1,n=5 B.m=3,n=
科目:高中化学 来源:湖北省天门中学2008-2009学年高二下学期5月月考化学试题(A卷) 题型:022
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
Ⅰ:配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于________晶体.
Ⅱ:配合物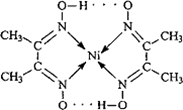 分子内的作用力有________(填编号).
分子内的作用力有________(填编号).
A.氢键
B.离子键
C.共价键
D.金属键
Ⅲ.氢气是新型清洁能源,但难储运.研究发现,合金可用来储藏氢气.镧(![]() )和镍(
)和镍(![]() )的一种合金就是储氢材料.该合金的晶胞如图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中.
)的一种合金就是储氢材料.该合金的晶胞如图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中.

(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收3个H2,这一过程用化学方程式表示为:________.
(2)下列关于该贮氢材料及氢气的说法中,正确的是________(填序号)
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
(3)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上.若把其中两个CO配位体换成NH3得到新的配合物,则以下物质中互为同分异构体的是________.(填字母编号,任填一组)(图中黑点为NH3,圆圈为CO,Ni略去)

查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省福州文博中学高二上学期期末考试化学试卷(带解析) 题型:单选题
Co(III)的八面体(配位数为6)配合物化学式为CoClm·n NH3,若1 mol配合物与AgNO3作用生成1 molAgCl沉淀,则m、n的值是( )
| A.m=1,n=5 | B.m=5,n=1 | C.m=3,n=4 | D.m=4,n=5 |
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二上学期期末考试化学试卷(解析版) 题型:选择题
Co(III)的八面体(配位数为6)配合物化学式为CoClm·n NH3,若1 mol配合物与AgNO3作用生成1 molAgCl沉淀,则m、n的值是( )
A.m=1,n=5 B.m=5,n=1 C.m=3,n=4 D.m=4,n=5
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧(![]() ) 和镍(
) 和镍(![]() ) 的一种合金就是储氢材料。该合金的晶胞如下图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如下图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。

(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
E.已知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:

①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)
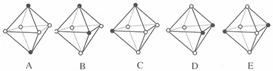
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
① CO可以和很多过渡金属形成配合物。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO中中心原子的杂化类型为 杂化,与CO互为等电子体的分子和离子有(各写一种): 、 。
② Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
③ Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 ,得到新的配合物有 种
④ 配合物 分子内的作用力有 (填编号)。
分子内的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
 ⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
(3)铜是是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。
⑥ CuH的晶体结构如图所示,该晶体中Cu+的配位数为 。CuH具有许多特殊性质,如易分解、能与水反应、在氯气中燃烧等。写出CuH在氯气中燃烧的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com