
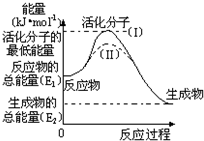
 在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.认真观察如图,然后回答问题.
在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.认真观察如图,然后回答问题.| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
| B、少量金属钠投入到CuSO4溶液中:2Na+Cu2+═2Na++Cu↓ |
| C、SO2通入CaCl2溶液中:SO2+H2O+Ca2+═CaSO3↓+2H+ |
| D、过氧化钠与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl=NH3↑+HCl↑ |
| B、Mg+2HCl=MgCl2+H2↑ |
| C、CaO+CO2=CaCO3 |
| D、NaCl+AgNO3=AgCl↓+NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铜及其化合物在工农业生产及日常生活中应用非常广泛.
铜及其化合物在工农业生产及日常生活中应用非常广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
 过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:
 外,还有
外,还有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
HA物质的量 浓度/(mol?L-1) |
NaOH物质的量 浓度/(mol?L-1) |
混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
| c(OH-) |
| c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com