
| A. | 1molKClO3所具有的总能量高于1molKCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1gKClO3,1gMnO2,0.1g Mn2O7混合加热,充分反应后MnO2质量为1g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
分析 A.反应2KClO3=2KCl+3O2为放热反应,反应物总能量高于生成物所具有的总能量之和;
B.由分解机理可知,KClO3的分解速率取决于慢反应,即反应①;
C.由反应②可知,0.1 g Mn2O7分解会生成一部分MnO2;
D.将固体二氧化锰碾碎,可加快反应①的反应速率;
解答 解:A.反应2KClO3=2KCl+3O2为放热反应,故1 mol KClO3所具有的总能量高于1 mol KCl和1.5 mol O2所具有的总能量之和,故A正确,
B.由分解机理可知,KClO3的分解速率取决于慢反应,即反应①,故B正确;
C.由反应②可知,0.1 g Mn2O7分解会生成一部分MnO2,故反应后MnO2的总质量大于1 g,故C错误;
D.将固体二氧化锰碾碎,增大接触面积可加快反应①的反应速率,故D正确;
故选C.
点评 本题考查反应速率影响因素、吸热反应与放热反应等,题目难度中等,学生容易定式思维认为催化剂不变,忽略开始加入的Mn2O7分解会生成一部分MnO2.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题

| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 12mol•L-1盐酸溶液与足量MnO2共热,反应生成的气体分子数为0.3NA | |
| B. | 密闭反应容器中充入2mol SO2和1mol O2,充分反应转移电子数为4NA | |
| C. | 25.0g胆矾晶体溶于水配成1L溶液,所得溶液中阳离子数为0.1NA | |
| D. | 常温常压下,0.1mol C5H12所含有的共价键数目为1.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
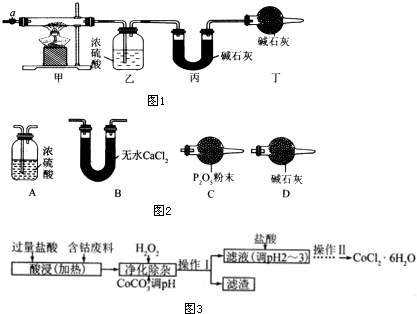
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
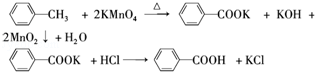
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
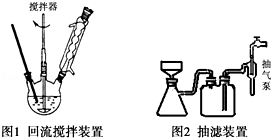
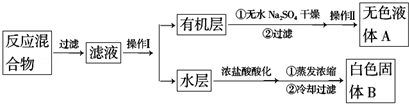
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com