
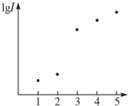
 电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )| A. | 第ⅠA族 | B. | 第ⅡA族 | C. | 第ⅢA族 | D. | 第ⅣA族 |
科目:高中化学 来源: 题型:选择题
| A. | 可加入酸性KMnO4溶液鉴别苯、环己烯和己烷 | |
| B. | 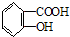 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 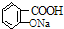 | |
| C. | 向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 | |
| D. | 利用盐析、过滤可将蛋白质和NaCl溶液分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Y 表示的化学反应速率为0.005 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若升高温度Y的转化率减小,则正反应为放热反应 | |
| D. | 达到平衡时,Y与Z的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S只作还原剂 | |
| B. | 该反应是氧化还原反应 | |
| C. | S元素被还原 | |
| D. | 当1 mol O2参加反应时,共转移4 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同周期元素的原子电子层数相同 | |
| B. | (长式)元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| C. | 最外层电子数相同的元素都是同一族的元素 | |
| D. | 同一主族元素的原子最外层电子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 硼原子以sp杂化 | |
| C. | 氯化硼晶体为分子晶体 | |
| D. | 氯化硼是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性强弱:Na>Mg>Al | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 酸性强弱:HIO4>HBrO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com