
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
分析 X、Y、Z、W是元素周期表前四周期中的常见元素,X的基态原子L层电子数是K层电子数的2倍,所以X基态原子核外有6个电子,则X是C元素;
Y的基态原子最外层电子排布式为:nsnnpn+2,s能级上最多排2个电子,且p能级上还有电子,所以n为2,则Y的基态原子最外层电子排布式为:2s22p4,所以Y是O元素;
Z存在质量数为23,中子数为12的核素,则其质子数是11,所以Z是Na元素;
W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,氢氧化亚铁在空气中会迅速变成灰绿色,最后变成红褐色氢氧化铁,所以W是Fe,据此进行解答.
解答 解:X、Y、Z、W是元素周期表前四周期中的常见元素,X的基态原子L层电子数是K层电子数的2倍,所以X基态原子核外有6个电子,则X是C元素;Y的基态原子最外层电子排布式为:nsnnpn+2,s能级上最多排2个电子,且p能级上还有电子,所以n为2,则Y的基态原子最外层电子排布式为:2s22p4,所以Y是O元素;Z存在质量数为23,中子数为12的核素,则其质子数是11,所以Z是Na元素;W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,氢氧化亚铁在空气中会迅速变成灰绿色,最后变成红褐色氢氧化铁,所以W是Fe元素,
(1)同周期随原子序数增大,元素电负性增大,故C的电负性比O的小,
故答案为:小;
(2)W为铁元素,它的基态原子核外电子排布式为:1s22s22p63s23p63d64s2,则价电子排布式是3d64s2;
Z2Y2与XY2分别为Na2O2、CO2,二者反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2;1mol过氧化钠与二氧化碳完全反应生成0.5mol氧气,转移了1mol电子,转移的电子数目为NA(或6.02×1023),
故答案为:3d64s2; 2Na2O2+2CO2═2Na2CO3+O2;NA(或6.02×1023);
(3)X、Y分别为C、O元素,与C、O元素形成的一种分子与该无机阴离子在水溶液中反应的离子方程式为:CO2+CO32-+H2O═2HCO3-,
故答案为:CO2+CO32-+H2O═2HCO3-;
(4)X为C元素,Y为Si元素,二者形成的化合物分别为甲烷、SiH4,二者形成的晶体都是分子晶体,相对分子质量越大,分子间作用力越强,其沸点越高,则沸点较高的为SiH4,
故答案为:SiH4.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
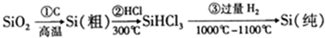 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 步骤①的化学方程式为:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1mol Si,转移2mol电子 | |
| C. | 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
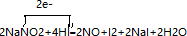 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
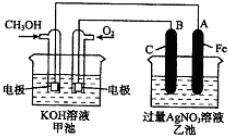
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=3和pH=5的硫酸溶液等体积混合,所得溶液的pH约为3.3 | |
| B. | 1 L 0.5 mo1•L-1稀硫酸与1 L 1 mo1•L-1NaOH溶液混合反应放出57.3 kJ的热量,则表示中和热的热化学方程式为: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1),△H=-114.6 kJ•mo1-l | |
| C. | 已知室温时,0.1 mol•L-1某一元酸HA的电离平衡常数约为1×10-7,则该酸的电离度为0.01% | |
| D. | 已知常温下Ag2CrO4的Ksp=1.12×10-12.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,则有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 H2SO4 | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH-)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阴离子的还原性:Z>Y>X | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:X<Y<Z | D. | 原子原子半径:X>Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com