
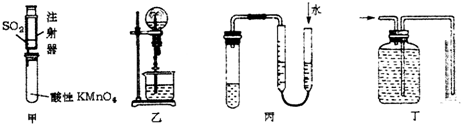
| A. | 可用甲装置来探究SO2的漂白性 | |
| B. | 可用乙装置验证HCl气体极易溶于水 | |
| C. | 用图示的方法可以检查丙装置的气密性 | |
| D. | 可用丁装置测量铜与稀硝酸反应生成气体的体积 |
分析 A.二氧化硫的还原性使酸性高锰酸钾褪色,而不是漂白性;
B.HCl气体极易溶于水;
C.利用压强差检验装置的气密性;
D.铜与稀硝酸反应生成NO,一氧化氮不溶于水,可用排水法收集.
解答 解:A.探究SO2的漂白性,应该用品红溶液,不能用高锰酸钾,故A错误;
B.HCl气体极易溶于水,可形成喷泉,故B正确;
C.如果装置的气密性良好,甲、乙两侧水面高度不同,否则水面相同,所以能检验装置的气密性,故C正确;
D.铜与稀硝酸反应生成NO,NO不溶于水,可用排水法收集,所以图示装置可用于收集并测定铜与稀硝酸反应生成的气体及体积,故D正确.
故选A.
点评 本题考查了化学实验方案设计,涉及非金属性强弱的判断、气密性检验、气体的收集方法等知识点,明确实验原理是解本题关键,根据气体的密度等知识点来分析解答,易错选项是A.


科目:高中化学 来源: 题型:选择题
| A. | 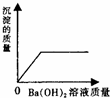 | B. | 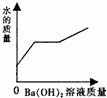 | C. | 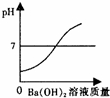 | D. | 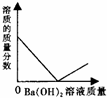 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能含甲烷 | B. | 可能是甲烷和丙炔的混合气体 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定含乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 | |
| D. | 不同pH的溶液中有:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. HN3+OH-.
HN3+OH-. ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2为还原产物 | |
| B. | 当x=2时,每生成1 mol N2,转移电子数为4 mol | |
| C. | 等物质的量N2和CO2中,共价键的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和环丙烷 | B. | 甲烷和乙烷 | C. | 丙烯和丙烷 | D. | 丙烷和环丙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com