
| A. | 溶液褪色 | B. | 产生白色沉淀 | C. | 无明显现象 | D. | 产生黄色沉淀 |
科目:高中化学 来源: 题型:解答题
 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu (CuO),加盐酸,过滤 | B. | Na2CO3 (NaHCO3)固体,加热 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,过滤 | D. | MgO (Al2O3),加烧碱溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有6.02×1023个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 在常温常压下,11.2 L Cl2含有的分子数为0.5×6.02×1023 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3×6.02×1023 | |
| D. | 标准状况下,11.2 L H2O含有的分子数为0.5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
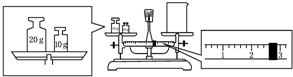 实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液245mL:
实验室欲用NaOH固体配制1.0mol•L-1的NaOH溶液245mL:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com