
| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 加入催化剂有利于氨的合成 | |
| D. | 工业制取金属钾的反应为:Na(l)+KCl(l)?NaCl(l)+K(g) |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可以勒夏特列原理解释,故A不选;
B.该反应的正反应是一个气体体积减小的反应,增大压强平衡正向移动,所以高压比常压有利于合成SO3的反应,能用勒夏特列原理解释,故B不选;
C.催化剂只影响反应速率不影响平衡移动,所以不能用勒夏特列原理解释,故C选;
D.由于K为气态,将钾分离出来,降低了产物的浓度,平衡正向移动,能用勒夏特列原理解释,故D不选;
故选C.
点评 本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理适用范围是解本题关键,只有能引起平衡移动的因素才能用平衡移动原理解释,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2气体通入Na2SiO3溶液中 | B. | SO2气体通入Ca(OH)2溶液中 | ||
| C. | CO2气体通入饱和Na2CO3溶液中 | D. | SO2气体通入CaCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷的主要成分是硅酸盐 | B. | 硅可用作半导体材料 | ||
| C. | 电解氯化钠溶液制取金属钠和氯气 | D. | 铁槽可存放冷的浓硝酸、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Na+NO3- Cl- | B. | K+ Na+Cl- NO3- | ||
| C. | K+ Na+ Cl-AlO2- | D. | K+ HCO3- SO42-NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
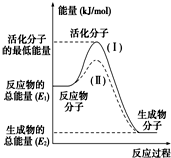 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
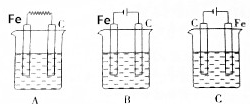
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molAl与足量盐酸反应转移电子数为1NA | |
| B. | 标准状况下,22.4L氨气与22.4L氮气所含原子数均为2NA | |
| C. | 7.8gNa2O2所含的离子数为0.3NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com