
【题目】化学计量是化学学习的工具,请回答下列问题:
(1)标准状况下,1.7gNH3与__LH2S气体含有的氢原子数相同。
(2)VmLAl2(SO4)3溶液中含Al3+ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是___mol/L。
(3)常温常压下22.4LCO2中分子个数__64克SO2的分子个数(填“>”、“<”或“=”)。
(4)标准状况下,33.6L的NH3所含电子的物质的量约为__mol。
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为__。
(6)某盐混合溶液含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=___。
(7)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为___,NH3的体积分数(即NH3的体积与混合气体总体积的比值)为__。
【答案】3.36L ![]() < 15 24.5L/mol 0.15mol/L 16.8g/mol 80%
< 15 24.5L/mol 0.15mol/L 16.8g/mol 80%
【解析】
(1)要使氨气与硫化氢氢原子个数相等,应满足:![]() ,解得V=3.36L,
,解得V=3.36L,
故答案为:3.36L;
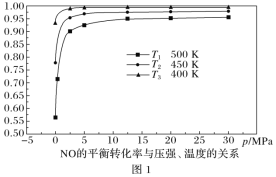
(2)VmLAl2(SO4)3溶液中含Al3+ag,溶液中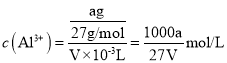 ,取出的0.5VmL溶液中含
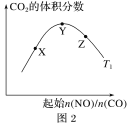
,取出的0.5VmL溶液中含![]() ,稀释至2VmL,溶液中
,稀释至2VmL,溶液中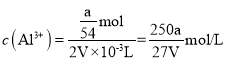 ,溶液中
,溶液中![]() ,
,
故答案为:![]() ;
;
(3)常温常压下,气体摩尔体积大于22.4L/mol,22.4LCO2的物质的量小于1mol,分子数小于NA,64gSO2的物质的量为![]() =1mol,分子数为NA,
=1mol,分子数为NA,
故答案为:<;
(4)标准状况下,33.6L的NH3的物质的量![]() ,所含电子的物质的量为1.5mol×(7+3×1)=15mol,
,所含电子的物质的量为1.5mol×(7+3×1)=15mol,
故答案为:15;
(5)该条件下,气体摩尔体积![]() ,
,
故答案为:![]() ;
;
(6)溶液呈电中性,溶液中电荷守恒为:![]() ,代入数据可得
,代入数据可得![]() =0.15mol/L,
=0.15mol/L,
故答案为:0.15mol/L;
(7)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,混合气体平均摩尔质量:m=ρVm=0.75g/L×22.4L/mol=16.8g/mol;设NH3与CH4的物质的量分别为x、y,则![]() =16.8,解得x:y=4:1,物质的量比等于体积比,则NH3的体积分数为
=16.8,解得x:y=4:1,物质的量比等于体积比,则NH3的体积分数为![]() ×100%=80%,
×100%=80%,
故答案为:16.8g/mol;80%。


科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g)ΔH1=a kJ·mol-1
2NO(g)ΔH1=a kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g)ΔH2=b kJ·mol-1
2NO2(g)ΔH2=b kJ·mol-1
③CO(g)+![]() O2(g)
O2(g)![]() CO2(g)ΔH3=c kJ·mol-1
CO2(g)ΔH3=c kJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g)ΔH4
N2(g)+2CO2(g)ΔH4
请回答下列问题:
(1)根据反应①②③,确定反应④中ΔH4=________ kJ·mol-1。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=____________________________________(用表达式表示)。
(3)下列情况能说明反应②已达平衡状态的是________(填字母)。
a.单位时间内生成1 mol NO2的同时消耗了1 mol NO
b.在恒温恒容的容器中,混合气体的密度保持不变
c.在绝热恒容的容器中,反应的平衡常数不再变化
d.在恒温恒压的容器中,NO的体积分数保持不变
(4)试分析高温下不利于反应③自发进行的原因______________________________。
(5)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图所示的曲线。试分析实际化工生产中不采用高压的原因______________________________。
(6)探究反应④中平衡时CO2的体积分数与反应物中起始n(NO)/n(CO)的比值、温度的关系,得到如图所示的曲线。在X、Y、Z三点中,CO的转化率从大到小的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是( )

A.C3N4中C的化合价为-4 B.反应的两个阶段转移电子数相等
C.阶段Ⅱ中,H2O2既是氧化剂,又是还原剂 D.通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4.考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
![]()
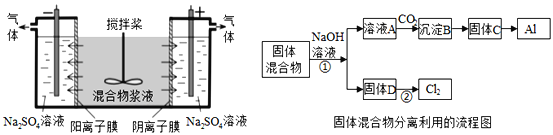
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)C→Al的制备方法称为电解法,请写出阳极反应方程式_____________________.
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2.由此判断影响该反应有效进行的因素有(填序号)_____。
A.温度 B.溶液的pH值 C.Cl-和![]() -的浓度
-的浓度
(3)固体D是碱性锌锰电池的正极,请写出该电池的负极反应方程式_____________ 。
(4)0.2molCl2与焦炭、TiO2完全反应,生成CO和TiCl4(熔点-25℃,沸点136.4℃)放热8.56kJ,该反应的热化学方程式为______________________________________.
Ⅱ.含铬元素溶液的分离和利用
(5)用惰性电极电解时,![]() 能从浆液中分离出来的原因是_________________,
能从浆液中分离出来的原因是_________________,
分离后得到的含铬元素的粒子有![]() ﹣和
﹣和![]() ﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
①若130gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___。
②该反应中的氧化剂是___,氧化产物是___。
(2)O3能与KI溶液反应,生成一种能使带火星木条复燃的气体,向反应后溶液中滴入酚酞变为红色,若滴入淀粉溶液则变为蓝色。为测定大气中O3的含量,将0℃、1.01×105Pa、33.6m3的空气通入KI溶液,使之完全反应,再向所得溶液中滴加0.01mol/L的Na2S2O3溶液60mL恰好与之完全反应。(I2与Na2S2O3的反应式:2NaS2O3+I2=Na2S4O6+2NaI)
①写出并配平O3与KI溶液反应的化学方程式___;
②计算大气中O3的体积分数(即O3的体积与空气体积的比值,用科学记数法表示)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前比较热门的Al-H2O2电池,其电池总反应为2Al+![]() =
=![]() +OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
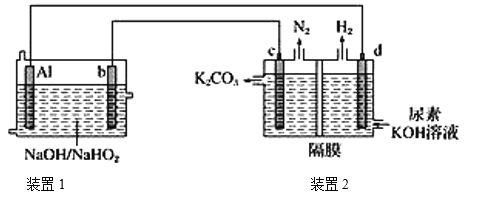
A.装置1中Na+移向电极b,装置2中的隔膜可以换成质子交换膜
B.电极c的电极反应式:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O
C.电解时,电流的流动路径:Al极→导线→d极→电解质溶液→c极→导线→b极
D.通电5 min后,若Al电极的质量减轻5.4g,则产生H2的体积为4.48L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有相同的电子层结构的四种微粒:aAn+、bB(n+1)+、cCn-、dD(n+1)-,关于A、B、C、D四种元素叙述正确的是
A.一定都是短周期元素
B.原子序数:B > A > C > D
C.单质的还原性:B > A
D.气态氢化物的稳定性:D > C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对相应有机物的描述完全正确的是( )
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④油脂:属于高分子化合物,可以发生水解反应
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥糖类、油脂、蛋白质:人类必需的三大营养物质
⑦聚酯纤维、碳纤维、光导纤维:都属于有机高分子材料.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
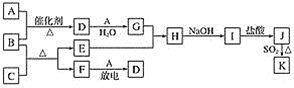
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com