
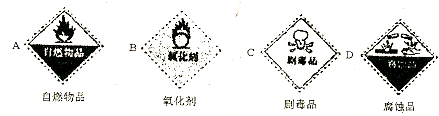
分析 (1)浓硫酸具有强腐蚀性;
(2)①加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;
②加热条件下,Cu和浓硫酸反应,但和稀硫酸不反应;
酸能使紫色石蕊试液变红色;
③硫酸铜粉末为白色,而硫酸铜溶液为蓝色;
(3)Cu和氧气反应生成CuO,CuO和稀硫酸反应生成硫酸铜和水;
(4)酸性条件下,Cu和稀硫酸反应生成硫酸铜和水;
(5)将硫酸铜溶液中获取胆矾需要的实验操作是蒸发浓缩、冷却结晶、过滤.
解答 解:(1)浓硫酸具有强腐蚀性,所以其标签应该是D,故答案为:D;
(2)①加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②加热条件下,Cu和浓硫酸反应,但和稀硫酸不反应,所以反应后的溶液中还含有硫酸;
酸能使紫色石蕊试液变红色,硫酸根离子用盐酸酸化的氯化钡溶液检验,其检验方法为:取反应后溶液少许于试管中,加入紫色石蕊试液,如果溶液变红色,说明含有氢离子,则含有稀硫酸;
故答案为:加热条件下,Cu和浓硫酸反应但和稀硫酸不反应;取反应后溶液少许于试管中,加入紫色石蕊试液,如果溶液变红色,说明含有氢离子,则含有稀硫酸;
③硫酸铜粉末为白色,而硫酸铜溶液为蓝色,将白色固体溶于水后,溶液变蓝色,说明白色固体为CuSO4,
故答案为:CuSO4;
(3)由2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4=CuSO4+H2O可知,不生成有毒气体二氧化硫,且使用的硫酸量少,则其优点为不产生污染环境的气体、硫酸用量少,故答案为:不产生污染环境的气体;硫酸用量少;
(4)酸性条件下,Cu和稀硫酸反应生成硫酸铜和水,离子方程式为Cu+H2O2+H+=Cu2++2H2O,
故答案为:Cu+H2O2+H+=Cu2++2H2O;
(5)将硫酸铜溶液中获取胆矾需要的实验操作是蒸发浓缩、冷却结晶、过滤,
故答案为:蒸发浓缩;冷却结晶;过滤.
点评 本题以Cu和浓硫酸反应为载体考查物质制备及化学实验方案评价,为高频考点,侧重考查学生实验操作、实验评价及分析判断能力,明确化学反应原理及实验评价方法是解本题关键,化学实验要考虑环境保护、药品用量、实验操作的可行性等方面,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
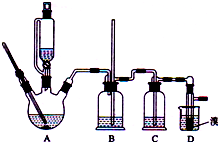 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
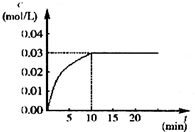 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3溶液在空气中加热蒸干并灼烧后,可以得到Fe2(SO4)3 | |
| B. | 为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下,加入氨水,过滤后向滤液中再加入适量盐酸 | |
| C. | 配制FeSO4溶液时,为了抑制亚铁离子水解,需加入少量Fe | |
| D. | 室温下,向PH=4的醋酸溶液中加入等体积的PH=10的NaOH溶液,反应后溶液呈碱性,是因为生成了强碱弱酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com