
对于化学反应3W(g)+2X(g) =4Y(g)+3Z(g),下列反应速率关系中正确的是
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
科目:高中化学 来源: 题型:
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol ·L-1)随反应时间(min)的变化情况如下表所示。
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol ·L-1)随反应时间(min)的变化情况如下表所示。
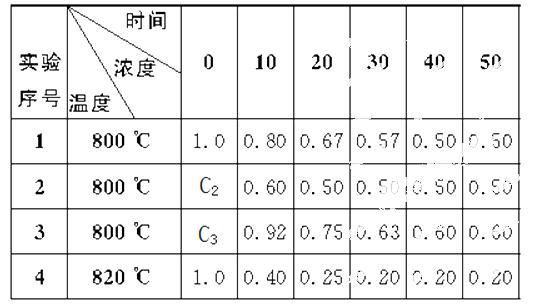
根据上述数据,完成下列填空:
(1)在实验1中,反应在10—20 min时间内平均反应速率为________mol ·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol ·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是_______________________ _____。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3____v1(填“>”“=”或“<”),且c3____1.0 mol ·L-1(填“>”“=”或“<”)。
(4)在实验4中,反应在20—30 min时间内平均反应速率为________。
比较实验4和实验1,可推测该反应是_______(填“吸热”或“放热”)反应,结合表中数据说明原因______ _ _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) 1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A 加催化剂同时升高温度 B 加催化剂同时增大压强
C 升高温度同时充入N2 D 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
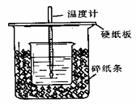 (1)从实验装置上看,图中尚缺少的一种
(1)从实验装置上看,图中尚缺少的一种
玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (偏大、偏小、无影响)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.化学反应过程都伴随着能量变化
B.放热反应的发生无需任何条件
C.H2SO4和NaOH的反应是吸热反应
D.化学键的断裂和形成与反应放热和吸热无关
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液
B.任何浓度的溶液都可以用pH来表示其酸性的强弱
C.无论是纯水、酸性、碱性或中性稀溶液,常温下,其c(H+)·c(OH-)=1×10-14
D.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在298K时下述反应的有关数据:
C(s) +1/2 O2(g) =CO(g) △H1=-110.5kJ/mol
C(s) +O2(g) =CO2(g) △H 2=-393.5kJ/mol
则C(s) +CO2(g) =2CO(g) 的△H 为
A.283kJ/mol B.-504 kJ/mol
C.-172.5kJ/mol D.172.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入一定量的CuO粉末.下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是
A.由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Na+、Cl-
B.酸性溶液中可能大量存在Na+、ClO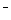 、SO42-、I
、SO42-、I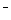
C.含有0.1 mol/L Fe3+ 的溶液中可以大量存在:K+、Mg2+、I-、NO3-
D.室温下,pH=l的溶液中一定可以存在:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com