
| A. |  称取NaOH固体 | B. | 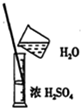 稀释浓硫酸 | ||
| C. | 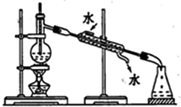 分离乙醇和水混合物 | D. | 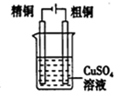 电解炼制铜 |
分析 A.NaOH易潮解,具有腐蚀性;
B.不能在量筒中稀释;
C.分离乙醇和水混合物,需要蒸馏实验,测定馏分的温度;
D.粗铜为阳极,阴极上析出Cu,可精炼Cu.
解答 解:A.NaOH易潮解,具有腐蚀性,应将NaOH放在小烧杯中称量,故A错误;
B.不能在量筒中稀释,应在烧杯中稀释,且浓硫酸注入水中,并用玻璃棒不断搅拌,故B错误;
C.分离乙醇和水混合物,需要蒸馏实验,测定馏分的温度,图中温度计的水银球应在烧瓶支管口处,冷却水应下进上出,故C错误;
D.由图可知,粗铜与电源正极相连,粗铜为阳极,电解质为硫酸铜,则阴极上铜离子得到电子析出Cu,可精炼Cu,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作、混合物分离提纯、电解原理及应用等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的综合考查,注意实验的评价性分析,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
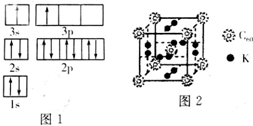 纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(KJ•mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1541 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
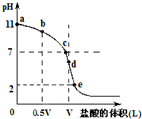 常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
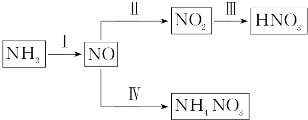
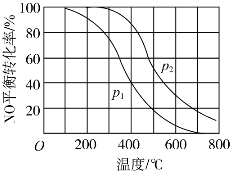
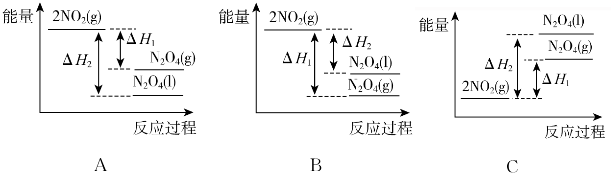
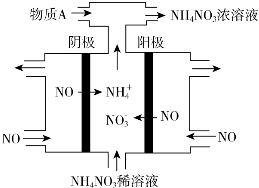
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
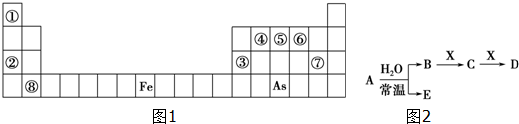
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com