
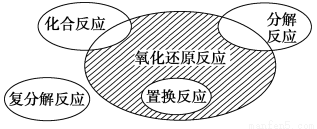
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是 ( )。
A.Cl2+2KBr=Br2+2KCl
B.2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.2Na2O2+2CO2=2Na2CO3+O2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:选择题
某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为
②mg该硫原子的物质的量为 mol
mol
③该硫原子的摩尔质量是aNAg
④ag该硫原子所含的电子数为16NA
A.①③ B.②④ C.①② D.②③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-2从铝土矿到铝合金练习卷(解析版) 题型:填空题
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g,称取时使用的仪器名称为 。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有 ;滤渣中含有 ;在溶解过滤时使用的主要玻璃仪器有 。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的化学方程式 。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g。有关反应的化学方程式为 。
(5)该样品中铝的质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-1钠、镁及其化合物练习卷(解析版) 题型:选择题
下列说法不正确的是 ( )。
A.Na2O2用作呼吸面具的供氧剂
B.NaHCO3的热稳定性大于Na2CO3
C.乙醇可与金属钠反应放出氢气
D.金属钠着火时,可用细沙覆盖灭火
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:选择题
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是 ( )。
A.氧化产物为Cl2
B.参加反应的氧化剂与还原剂的物质的量之比为1∶2
C.若有3 mol H2O生成,则反应中有2 mol电子转移
D.当该反应生成2.24 L Cl2(标准状况)时,反应中有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:选择题
某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-、CO32-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色。为确定该溶液的组成,还需检验的离子是 ( )。
A.K+ B.SO42- C.Ba2+ D.NH4+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:填空题
取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式: ,
反应后得到的溶液呈 色。用此溶液分别做如下实验:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为 ,此反应属于 (填反应类型)。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体。
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中的液体产生丁达尔效应。这个实验可以用来区别 。
(4)用Fe(OH)3胶体进行下列实验:
①将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,这说明 ,这种现象称为 。
②向其中加入饱和(NH4)2SO4溶液发生的现象是 ,原因是 ,
③向其中滴入过量稀硫酸,现象是 ,其原因是 。
④提纯此分散系常用的方法是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:选择题
实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为 ( )。
A.950 mL;201.4 g B.1 000 mL;212.0 g
C.100 mL;21.2 g D.500 mL;100.7 g
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(二)(解析版) 题型:填空题
党的十八大报告中首次提出“美丽中国”的宏伟目标。节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,下图是几种工业生产的联合生产工艺:

请回答下列问题:
(1)装置甲为电解池,根据图示转化关系可知:A为____________(填化学式),阴极反应式为____________。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是_________________________________________________
装置戊进行反应时需要的环境为________(填字母序号)。
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)??CH3OH(g) ΔH<0。
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 350 |
K | 2.041 | x |
符合表中的平衡常数x的数值是________(填字母序号)。
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO) | c(H2) | c(CH3OH) |
0 min | 0.8 mol·L-1 | 1.6 mol·L-1 | 0 |
2 min | 0.6 mol·L-1 | y | 0.2 mol·L-1 |
4 min | 0.3 mol·L-1 | 0.6 mol·L-1 | 0.5 mol·L-1 |
6 min | 0.3 mol·L-1 | 0.6 mol·L-1 | 0.5 mol·L-1 |
反应从2 min到4 min之间,H2的平均反应速率为________。反应达到平衡时CO的转化率为________。反应在第2 min时改变了反应条件,改变的条件可能是________(填字母序号)。
A.使用催化剂 B.降低温度
C.增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为____________ ________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com