
【题目】以硫化铜精矿为原料生产CuCl的工艺过程如下:
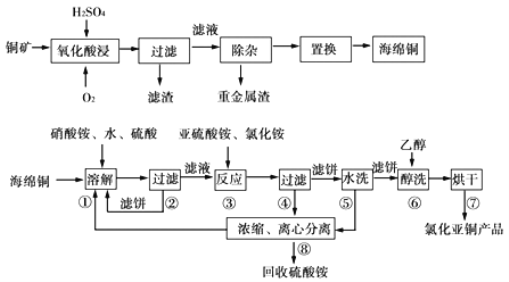
已知CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式_____________
(2)步骤①中得到的氧化产物是____________,溶解温度应控制在60—70℃,原因是_____________。
(3)写出步骤③中主要反应的离子方程式_____________。
(4)步骤③先加NH4Cl、再加入亚硫酸铵时无沉淀,加水稀释就产生大量臼色沉淀,其原因_____________。
(5)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是_____________。
(7)上述浓缩液中含有Iˉ、CIˉ等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中中![]() 为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
为_____________。(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
【答案】2CuS+2H2SO4+O2=2CuSO4+2S+2H2OCuSO4或Cu2+温度低溶解速度慢,温度过高铵盐分解2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀硫酸醇洗有利于加快去除CuCl表面水分防止其水解氧化4.72×10-7
【解析】
(1)由题意知氧化酸浸过程有单质S、CuSO4和H2O生成,所以此反应的化学方程式2CuS+2H2SO4+O2=2CuSO4+2S+2H2O。
(2)由于酸性条件下硝酸根离子具有强氧化性,可氧化Cu生成CuSO4或Cu2+。溶解温度应控制在60-70℃,原因是温度太低溶解速度慢,温度过高铵盐分解。故答案为:CuSO4或Cu2+;温度低溶解速度慢,温度过高铵盐分解。
(3)酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生反应的离子方程式为:2Cu2++ SO32-+2Cl-+H2O=2CuCl![]() + SO42-+2H+。答案: 2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+。
+ SO42-+2H+。答案: 2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+。
(4)CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。所以步骤3先加NH4Cl,氯离子浓度较大,产生的氯化亚铜能溶于氯离子浓度较大的体系;氯化亚铜难溶于水,所以加水稀释就产生大量白色沉淀。
(5)因为在潮湿空气中CuCl易水解、氧化,为了防止CuCl溶解氧化引入新杂质,所以应加入硫酸,不能加入硝酸等氧化性酸,因为CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,所以也不能加入盐酸。答案:硫酸。
(6)步骤⑥为醇洗,因乙醇沸点低,易挥发, CuCl又难溶于醇,所以用乙醇洗涤,可快速除去固体表面的水分,防止CuCl水解、氧化,故答案为:醇洗有利于加快去除CuCl表面水分防止其水解氧化。
(7)根据沉淀溶解平衡常数:溶液中![]() =
=![]() [c(Ag+)/c(Ag+))]= Ksp(AgI)/ Ksp(AgCl) =(8.5×10-17) / (1.8×10-10)= 4.72×10-7答案:4.72×10-7。
[c(Ag+)/c(Ag+))]= Ksp(AgI)/ Ksp(AgCl) =(8.5×10-17) / (1.8×10-10)= 4.72×10-7答案:4.72×10-7。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
B. 标准状况下,18g冰水中共价键的数目为NA
C. 56g铁与71gCl2充分反应,转移电子数目为3NA
D. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代。正确的是( )
A.原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动
B.目前我国广大农村生活做饭使用的都是化石原料
C.多能源时代指的是新能源时代,包括核能、太阳能、氢能
D.化石燃料的燃烧没有污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 | A | B | C | D |
物质 | CO2 | MgCl2 | HCl | NaOH |
所含化学键类型 | 共价键 | 离子键、共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 共价化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的数値,下列说法正确的是( )
A. 常温常圧下,7.0g由丁烯与丙烯組成的混合气体中含有的氢原子数目为NA
B. 向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C. 6.4g铜与足量的硫单质混合加热,转移电子的数目为0.2NA
D. 标准状况下,2.24LSO3中含有0.1NA个SO3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
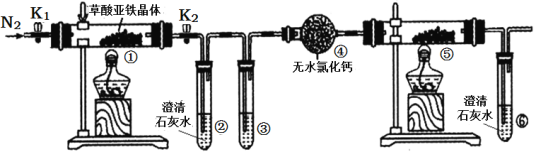
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1molDAx与足量的A2C反应生成44.8L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T→W(未配平),测得各物质的浓度如表所示。
物质 | T | G | W |
10min时,c/(mol/L) | 0.5 | 0.8 | 0.2 |
20min时,c/(mol/L) | 0.3 | 0.2 | 0.6 |
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,该化合物的化学式为_________。
(2)B、C、D、E的简单离子中,离子半径由大到小排序为__________。(用离子符号表示)
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,J、L混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式_______;J、L中能使酸性高锰酸钾溶液退色的是_______(填化学式)。
(4)B2A4-C2碱性燃料电池放电效率高。该电池放电时生成B2和A2C,正极反应式为_____;电池工作一段时间后,电解质溶液的pH_____(填“增大”“减小”或“不变”)。
(5)由A、B、C、D四种元素组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示,已知M耐高温。
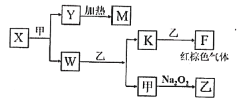
①X的电子式为______;W的结构式为________。
②已知W与乙反应生成K和甲是某重要化工生产步骤之一,提高其反应速率的方法除增大反应物浓度、增大压强外,还有______、______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com