
分析 将混有K2SO4、MgSO4的KNO3固体提纯的流程为,先将固体配制成溶液,除去SO42-、Mg2+离子的方法一般是使它们分别形成BaSO4和Mg(OH)2沉淀,所以需要加入稍过量的Ba(NO3)2和KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入Ba(NO3)2溶液,后加入K2CO3溶液,同时要注意不可加入BaCl2、Na2CO3和NaOH溶液进行除杂,也不可用稀盐酸调节溶液的pH,否则会引进Na+和NO3-杂质,以此解答该题.
解答 解:(1)后续实验是在溶液中进行的,需要加水溶解,操作①需要配制成溶液,需要加水溶解,故答案为:加水溶解;
(2)先加硝酸钡,除去硫酸根,再加氢氧化钠,除去镁离子,再加碳酸钠,除去多余的钡离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾;
先加氢氧化钾,除去镁离子,再加氯化钡,除去硫酸根,再加碳酸钾,除去多余的钡离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾;
先加入硝酸钡,除去硫酸根,再加碳酸钾,能把钙离子和多余钡离子除去,再加氢氧化钾,除去镁离子,最后加硝酸,除去多余的碳酸钾和氢氧化钾,
故答案为:Ba(NO3)2、K2CO3、KOH或KOH、Ba(NO3)2、K2CO3或Ba(NO3)2、KOH、K2CO3;
(3)加入过量硝酸钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴Ba(NO3)2溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:静置,取少量上层澄清溶液,再加入少量Ba(NO3)2溶液,若不变浑浊,表明SO42-已除尽;
(4)几个沉淀分别为BaSO4、BaCO3、Mg(OH)2,这几个沉淀反应互不干扰,因此只过滤一次,可减少操作程序,
故答案为:不需要;因为几个沉淀反应互不干扰,因此只过滤一次,可减少操作程序;
(5)因加入盐酸调节溶液的pH会引进Cl-,制不到纯净的KNO3溶液(E),所以该同学的实验设计方案中该步并不严密,
故答案为:不严密,因为加入盐酸调节溶液的pH会引进Cl-.
点评 本题考查混合物的分离提纯的综合应用,为高频考点,侧重于学生的分析能力、实验能力的考查,把握流程中的反应、混合物分离方法选择为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸密封保存 | |
| B. | 氢氟酸保存在玻璃瓶中 | |
| C. | 新制氯水保存在棕色试剂瓶中 | |
| D. | 烧碱溶液可用带橡皮塞的玻璃瓶暂时保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯 | B. | 甲烷和丁烯 | C. | 乙烷和乙烯 | D. | 乙烷和丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
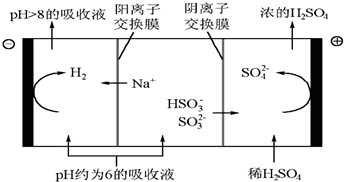
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向容量瓶中转移溶液 | B. |  中和热的测定 | ||
| C. | 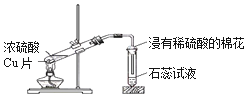 浓硫酸与铜的反应 | D. | 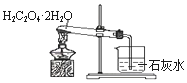 乙二酸晶体受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | V初 | V末 | V标 |
| 1 | 0.10mL | 9.71mL | 9.61mL |
| 2 | 1.50mL | 11.09mL | 9.59mL |
| 3 | 0.50mL | 11.10mL | 11.60mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com