
| A. | 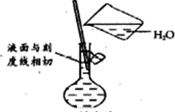 制溶液 | B. | 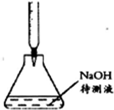 中和滴定 | ||
| C. | 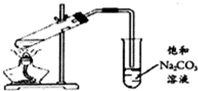 制备乙醇乙酯 | D. | 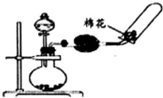 制备收集干燥的氨气 |
分析 A.配制一定浓度的溶液时,定容时需要改用胶头滴管;
B.酸溶液应该盛放在酸式滴定管中;
C.乙酸乙酯不溶于饱和碳酸钠溶液,可用碳环碳酸钠溶液吸收乙酸乙酯,且伸入试管中的导管在液面上方;
D.氨气密度小于空气,收集氨气导气管应该伸入试管底部.
解答 解:A.配制一定物质的量浓度的溶液过程中,在定容操作时,不能直接用烧杯加水,应该改用胶头滴管定容,故A错误;
B.待测液为氢氧化钠溶液,则标准液为酸,酸溶液应该盛放在酸式滴定管中,图示滴定管为碱式滴定管,故B错误;
C.乙酸乙酯不溶于饱和碳酸钠溶液,且碳酸钠溶液能够溶解乙醇、中和乙酸,所以制备乙酸乙酯时用饱和碳酸钠溶液吸收乙酸乙酯,为了防止倒吸,试管中的导管不能伸入液面中,图示装置合理,故C正确;
D.氨气的密度小于空气,所以收集氨气时,导气管应该伸入试管底部,图示装置不合理,故D错误;
故选C.
点评 本题考查了化学实验装置的应用,题目难度中等,明确化学实验基本操作方法为解答关键,注意掌握常见气体的性质及制取、收集方法,试题培养了学生的分析能力及化学实验能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
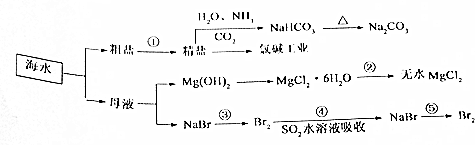
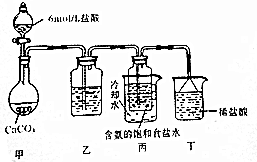
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②混合后c(H+)=c(CH3COO-)+c(OH-)+2c(SO42-) | |
| B. | ①和④溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)=0.01mol•L-1 | |
| C. | ②和③混合溶液中:c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 四种溶液各稀释100倍,溶液pH:④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 加压 | C. | 减压 | D. | 降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
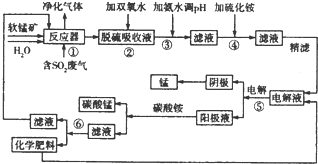
| 阳离子 | Fe2+ | Fe3+ | Mn2+ | Ni2+ | Co2+ | |
| 氢氧化物沉淀 | 开始沉淀的PH | 7.5 | 2.2 | 8.8 | 6.4 | 9.0 |
| 完全沉淀的PH | 9.5 | 3.5 | 10.8 | 8.4 | ||
| 硫化物沉淀 | 开始沉淀的PH | 6.2 | 4.67 | |||
| 完全沉淀的PH | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
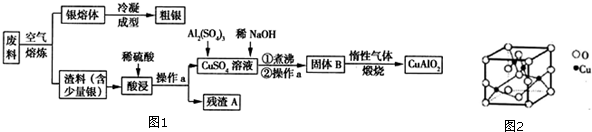
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在容器中共存 | ||
| C. | P、Q的反应速率相等内部 | D. | P、Q、R、S的浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
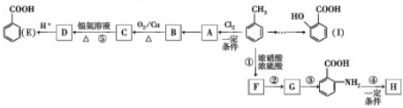
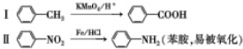
 .
. .写出③的转化关系
.写出③的转化关系 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$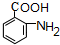 (用已知中的表达式表示,不用写化学方程式)
(用已知中的表达式表示,不用写化学方程式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com