
 2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.
2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.分析 (1)根据热化学方程式的含义以及书写方法来回答;
(2)①a.原电池工作时,电流由正极沿导线流向负极;
b.铂电极采用网状能增大气体的面积;
c.原电池工作时,电解质中的阴离子移向负极;
②根据电解食盐水的总反应来计算回答;
(3)①根据化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,列出平衡常数的表达式;根据升高温度乙醇的物质的量减小,平衡逆向移动,判断平衡常数的变化;
②根据化学反应速率是υ(H2)=2υ(CH3OH)计算;
③达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变;
④将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,反应速率增大,平衡向正反应方向移动,以此判断.
解答 解:(1)在298K时,1mol丙烷完全燃烧生成CO2和液态水放出2221.5kJ的热量,则该反应的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1,故答案为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1;
(2)①铝为负极,铂网为正极,海水为电解质溶液形成的原电池中,
a.原电池工作时,电流由正极沿导线流向负极,即电流由铂电极沿导线流向铝电极,故a错误;
b.铂电极采用网状能增大气体的面积,网状比块状更利于O2放电,故b正确;
c.原电池工作时,电解质中的阴离子移向负极,所以海水中的OH-向铝电极方向移动,故c正确;
故答案为:bc;
②电解氯化钠溶液反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,根据总反应当两极上共收集到448mL气体即0.02 mol气体时,则生成的氯气和氢气均是0.01mol,所以生成氢氧化钠的物质的量是0.02mol,所以氢氧化钠的浓度C=$\frac{n}{V}$=$\frac{0.02mol}{0.2L}$=0.1mol/L,所以pH=13,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;13;
(3)①化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,反应物的生成物都是气体,故平衡常数表达式为K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c{\;}^{2}(H{\;}_{2})}$,由图象可知升高温度乙醇的物质的量减少,平衡向逆反应方向移动,K减小,增大压强K值将不变;
故答案为:$\frac{c(CH{\;}_{3}OH)}{c(CO)c{\;}^{2}(H{\;}_{2})}$,减小;不变;
②υ(CH3OH)=$\frac{n{\;}_{B}}{t{\;}_{B}×3L}$mol/(L.min),故υ(H2)=2υ(CH3OH)=$\frac{2n{\;}_{B}}{3t{\;}_{B}}$mol/(L.min),
故答案为:$\frac{2n{\;}_{B}}{3t{\;}_{B}}$mol/(L.min);
③达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变,在体积不变时,气体的密度不变,不能作为判断是否达到平衡状态的依据,v生成(CH3OH)=v消耗(CO) 都是指一个方向,所以也不能作为判断是否达到平衡状态的依据,故答案为:c、d;
④将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有c(H2)/c(CH3OH)减小,
故答案为:c、d.
点评 本题是对热化学、电化学知识以及化学平衡的影响因素和化学平衡的标志等问题的综合考查,要求学生具有分析和解决问题的能力,题目难度中等,注意外界条件对化学平衡移动的影响以及平衡状态的判断角度.


科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D. | 4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 逆反应速率増大,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 逆反应速率减小,正反应速率増大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
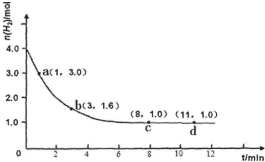 工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0某实验将3.0mol N2(g)和4.0mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应.测得H2的物质的量随反应时间的变化如图所示.
工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0某实验将3.0mol N2(g)和4.0mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应.测得H2的物质的量随反应时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W是由A、B两种元素组成的AB2型化合物.
W是由A、B两种元素组成的AB2型化合物.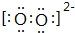 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
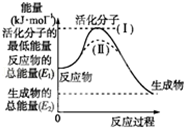 I.请认真观察图,然后回答问题.
I.请认真观察图,然后回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com