
【题目】下列过程中破坏的化学键只有共价键的是
A.石墨转化为金刚石B.NaOH溶于水C.干冰升华D.NH4Cl分解
科目:高中化学 来源: 题型:
【题目】以2—氯丙烷为主要原料制1,2—丙二醇CH3CH(OH)CH2OH时,经过的反应为( )
A.加成—消去—取代 B.消去—加成—取代
C.取代—消去—加成 D.取代—加成—消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能与Al反应放出H2的溶液中,一定能够大量共存的离子组是 ( )
A. Na+、SO42-、AlO2-、K+ B. SO42-、K+、Cl-、CO32-
C. NH4+、Cl-、SO42-、K+ D. K+、SO42-、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙两套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分.仪器中盛放的试剂为:a-无水乙醇(沸点:78℃);b-铜丝;c-无水硫酸铜;d--新制氢氧化铜悬浊液.
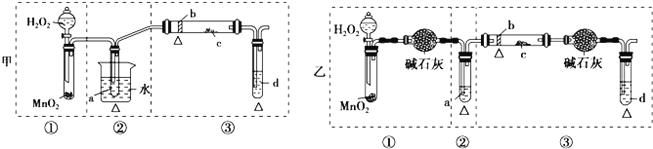 (1)简述乙方案的优点:________________________________________;
(1)简述乙方案的优点:________________________________________;
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为_________________________;
(3)实验中能验证乙醇氧化产物的实验现象是_______________________;
(4)装置中,若撤去第①部分,其他操作不变,则无水硫酸铜无明显变化,其余现象与(3)相同,推断燃烧管中主要反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 实验室用排水法收集氯气
B. 闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔
C. Cl-和Cl2均有毒
D. Cl-和Cl2均呈黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A. 漂粉精的主要成分为次氯酸钙
B. 实验室可用浓硫酸干燥氨气
C. 实验室可用NaOH溶液处理NO2、HCl废气
D. Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A.C14H18O5B.C14H16O4C.C14H22O5D.C14H10O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是主要的空气污染物,目前消除氯氧化物污染的方法有多种。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:________
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=___mol,NO2的转化率a1=_________.其它条件不变,反应在恒压条件下进行,平衡时NO2的转化率a2____a1(填“大于” 小于”或“ 等于” )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
时间 浓度(mol/L) 物质 | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据 是_________
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为_______ (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是________。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①该反应的ΔH____0(填“>”或“<”)。
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com