
| 滴定次数 | NaOH溶液体积(mL) | |
| V1 | V2 | |
| 1 | 3.05 | 44 |
| 2 | 1.45 | 41.5 |
| 3 | 7.65 | 47.6 |
| 40.05mL+39.95mL |
| 2 |
| c(标准)?V(标准) |
| V(待测) |
| 0.1000mol/L×0.04L |
| 0.02L |
| c(H+)c(A-) |
| HA |
| (1×10-a)×(1×10-a) |
| 0.2000-1×10-a |


科目:高中化学 来源:不详 题型:单选题
| A.④③①⑤② | B.④②③⑤① | C.①⑤③④② | D.③④①⑤② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
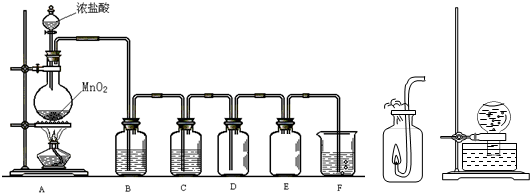
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.前者产生的氯气多 | B.一样多 |
| C.后者产生的氯气多 | D.无法比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com