A、B、C三种元素的原子具有相同的电子层数,且B的核外电子数比A多2个,C的质子数比B多4个,1molA的单质与酸反应,能置换出1gH2,这时,A转化为具有氖原子相同的电子层结构的离子.请回答下列问题:
(1)写出A、B、C的元素符号
(2)写出A的单质与水反应的离子方程式
(3)写出A与C单质化合的化学方程式.
【答案】
分析:A、B、C三种元素的原子具有相同的电子层数,则A、B、C三种元素处于同一周期,1molA的单质与酸反应,能置换出1gH
2,则A为金属,令A的化合价为x,根据电子转移守恒有x=1,A转化为具有氖原子相同的电子层结构的离子,故A为钠元素;B的核外电子数比A多2个,则B为铝元素;C的质子数比B多4个,则C为氯元素.
解答:解:A、B、C三种元素的原子具有相同的电子层数,则A、B、C三种元素处于同一周期,1molA的单质与酸反应,能置换出1gH
2,则A为金属,令A的化合价为x,根据电子转移守恒有x=1,A转化为具有氖原子相同的电子层结构的离子,故A为钠元素;B的核外电子数比A多2个,则B为铝元素;C的质子数比B多4个,则C为氯元素.
即A为钠元素;B为铝元素;C为氯元素.
(1)由上述分析可知,A为Na,B为Al,C为Cl,答:A、B、C的元素符号分别为Na、Al、Cl;
(2)A为钠元素,钠与水反应生成氢氧化钠与氢气,反应离子方程式为2Na+2H
2O═2Na
++2OH
-+H
2↑,答:2Na+2H
2O═2Na
++2OH
-+H
2↑;
(3)A为钠元素,C为氯元素,钠在氯气中燃烧生成氯化钠,反应方程式为2Na+Cl
2
2NaCl,答:2Na+Cl
2
2NaCl.
点评:本题考查物质性质与元素推断、化学用语,难度不大,根据计算推断A是解题关键,注意基础知识的掌握.

 2NaCl,答:2Na+Cl2
2NaCl,答:2Na+Cl2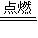 2NaCl.
2NaCl.



 如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)
如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)